
下列说法正确的是
A.电解质在溶液中存在电离平衡状态
B.电离平衡状态时v结合=v电离=0
C.弱电解质溶液中,既存在离子也存在分子
D.电解质的电离是可逆过程
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:填空题
下列物质:①Na ②Na2O ③NH3 ④HCl ⑤Ba(OH)2 ⑥NaCl ⑦蔗糖 ⑧NaCl溶液。(填序号)
(1)属于电解质的是 ,
(2)属于非电解质的是 ,
(3)能导电的是 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
用NA表示,下列说法中正确的有
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol•L-1的CaCl2溶液中含Cl-的数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:填空题
(12分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式 和化学名称 。
(3)写出X涉及化工生产中的一个化学方程式 。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(5)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为____________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式)。
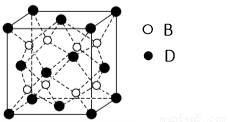
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上一次月考化学试卷(解析版) 题型:填空题
H2S溶于水的电离方程式为 。
(1)向H2S溶液中加入CuSO4溶液时,电离平衡向 (左或右,下同)移动,c(H+)_______,c(S2-)________。(填偏大、偏小、不变,下同)
(2)向H2S溶液中加入NaOH固体时,电离平衡向________移动,c(H+)_________,c(S2-)__________。
(3)若将H2S溶液加热至沸腾,c(H2S)____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高一10月月考化学试卷(解析版) 题型:选择题
将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是
A.液态氧、干冰、硫酸、烧碱、氯化钠
B.碘酒、冰、盐酸、烧碱、食盐
C.氢气、二氧化硫、硝酸、纯碱、硝酸钾
D.铜、硫酸钠、醋酸、石灰水、氯化铜
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期10月教学质检理综化学试卷(解析版) 题型:填空题
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关。
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2。
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是 (填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式 ,若利用B和C制备等量的氧气,则转移的电子数目之比为 。
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下:

①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是 。
②检验产品碳酸钠中是否含有氯化钠的操作方法为 。
③写出上述流程中X物质的分子式 ,副产品的一种用途为 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期;且原子序数依次增大。X、Z同主族;可形成离子化合物ZX;Y、M同主族;可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式);非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH =-a kJ·mol-1;写出X2M燃烧反应的热化学方程式: 。
(5)ZX的电子式为 ;ZX与水反应放出气体的化学方程式为 。
(6)熔融状态下;Z的单质和FeG2能组成可充电电池(装置示意图如下);反应原理为2Z+FeG2 Fe+2ZG
Fe+2ZG

放电时;电池的正极反应式为 ;充电时; (写物质名称)电极接电源的负极:该电池的电解质为
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:
2Ba2++ 40H一+2S042-+ Al3+=2BaS04↓+2H20+ Al02一
B.向NaHS04溶液中滴人Ba(OH)2溶液至S042-完全沉淀:
2 H++S042-+Ba2++20H- =BaS04↓+2H20
C.向0. 1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:
HA-十OH-=A2-+H20
D.向1L lmol.L-1的FeBr2溶液中通人等物质的量Cl2:
2Cl2 +2Fe2++2Br—=4Cl-十2Fe3++ Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com