
| A. | 常温下,加水稀释0.01mol•L-1的氨水,c(NH4+)•c(OH-)逐渐增大 | |
| B. | 在H2SO3溶液中滴加少量NaClO溶液,c(SO32-)逐渐增大 | |
| C. | 在H2S溶液中滴加CuSO4溶液,H2S的电离程度逐渐增大 | |
| D. | 微热醋酸溶液,$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$保持不变 |
分析 A.常温下,加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(NH4+)、c(OH-)都减小;
B.在H2SO3溶液中滴加少量NaClO溶液,二者发生氧化还原反应生成Cl-、SO42-;
C.硫化氢存在电离平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,发生反应H2S+Cu2+=CuS↓+2H+;
D.弱电解质的电离是吸热反应,升高温度促进醋酸电离.
解答 解:A.常温下,加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以溶液中c(NH4+)、c(OH-)都减小,导致c(NH4+)•c(OH-)逐渐减小,故A错误;
B.在H2SO3溶液中滴加少量NaClO溶液,二者发生氧化还原反应生成Cl-、SO42-,导致溶液中c(SO32-)逐渐减小,故B错误;
C.硫化氢存在电离平衡H2S?HS-+H+、HS-?H++S2-,在H2S溶液中滴加CuSO4溶液,发生反应H2S+Cu2+=CuS↓+2H+,H2S的电离程度逐渐增大,故C正确;
D.弱电解质的电离是吸热反应,升高温度促进醋酸电离,所以醋酸电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故D错误;
故选C.
点评 本题考查弱电解质的电离,为高频考点,涉及弱电解质的电离、氧化还原反应、复分解反应等知识点,明确弱电解质电离特点是解本题关键及发生的反应是解本题关键,注意:电离平衡常数只与温度有关,与溶液浓度无关,易错选项是BC.


科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
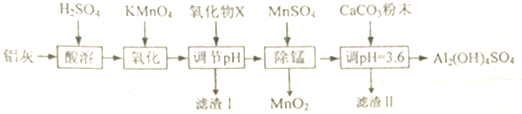
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
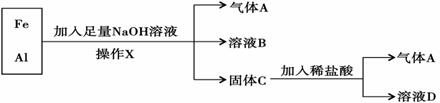
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为32 | B. | 质量数为15 | ||
| C. | ${\;}_{15}^{32}$P与${\;}_{15}^{33}$P互为同位素 | D. | 中子数为15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com