
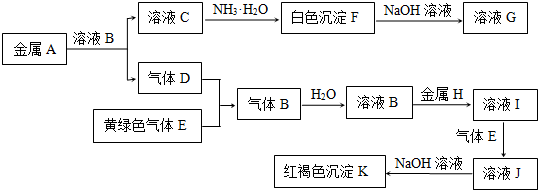
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
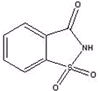 �Ǿ�������ϵĺϳ���ζ������1878�걻������ѧ�ҷ��֣�����ζ�����ǵ�300��500�������������л���գ��ڸ���ʳƷ���������ж����ȶ���ȱ���Ƿ�ζ��к�࣬��ʹ��Ӧ���ܵ�һ�����ƣ��Ǿ��Ļ�ѧ����Ϊ�ڱ����������ǰ�����ṹ��ʽ��ͼ��ʾ�����ķ���ʽΪ��������
�Ǿ�������ϵĺϳ���ζ������1878�걻������ѧ�ҷ��֣�����ζ�����ǵ�300��500�������������л���գ��ڸ���ʳƷ���������ж����ȶ���ȱ���Ƿ�ζ��к�࣬��ʹ��Ӧ���ܵ�һ�����ƣ��Ǿ��Ļ�ѧ����Ϊ�ڱ����������ǰ�����ṹ��ʽ��ͼ��ʾ�����ķ���ʽΪ��������| A��C7H8O3NS |
| B��C7H7O3NS |
| C��C7H6O3NS |
| D��C7H5O3NS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
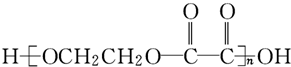 �Ĺ����ǣ�
�Ĺ����ǣ�| �� |
| �� |
| �� |
| �� |
| �� |
| �� |
| �� |
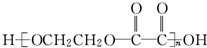
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
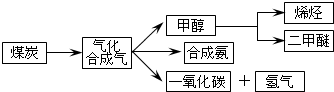
| c(H2)?c(CO) |
| c(H2O) |
| ���� | CH3OH | CH3OCH3 | H2O |
| c��mol/L�� | 0.8 | 1.24 | 1.24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ����Һ�����ܺ������������е�һ�ֻ��֣�Al3+��Cu2+��Na+��H+��
��һ����Һ�����ܺ������������е�һ�ֻ��֣�Al3+��Cu2+��Na+��H+���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������м�ˮ����ɴ���ϡ��Һ�Ĺ���H+��Ũ����С |
| B��ʵ������������Ϊ�˼ӿ췴Ӧ���ʣ�����ϡH2SO4�еμ�����Cu��NO3��2��Һ |
| C������ʱ��pH=2��CH3COOH��Һ��HCl��Һ��pH=12�İ�ˮ��NaOH��Һ��������Һ����ˮ�����c��H+����� |
| D�������£���ϡNaOH��Һ��CH3COOH��Һ��ϣ����ܳ���pH��7����c��OH-����c��Na+����c��H+����c��CH3COO-������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������β�����ŷ��������γɵ���Ҫԭ��֮һ |
| B�����ػ�����յĶ�����Ҫ���Ի�ѧ�� |
| C�������á�����̫���ܵ�ط���IJ����Ƕ������� |
| D��������ά�Dz����ֵ���ǿ�壬������������ǽ������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com