
����Ŀ���������ӷ���ʽ��д��ȷ����
A. �ö��Ե缫�������ʵ���Ũ�ȵ�FeBr2��CuCl2�����Һʱ���������Cu2+ + 2Br - ![]() Cu +Br2
Cu +Br2
B. ̼�����Ƶ�ˮ�ⷴӦ��HCO![]() ��H2O
��H2O![]() CO32- + H3O+
CO32- + H3O+
C. ���������Ũ�ȵ�Ba(OH)2ϡ��Һ��NH4HCO3ϡ��Һ��ϣ�Ba2++2OH-+NH4++HCO3 - = BaCO3��+NH3��H2O+H2O
D. ��ǿ����Һ��������������Fe(OH)3��Ӧ����Na2Fe2O4��3ClO- +2Fe(OH)3 = 2Fe2O42-+3Cl-+H2O+4H+
���𰸡�AC
��������A. �ö��Ե缫�������ʵ���Ũ�ȵ�FeBr2��CuCl2�����Һ���������ӵķŵ�˳���֪�����ʱ����������ͭ���ӵõ������ɵ���ͭ����������������ʧ�������ɵ����壬�����ܷ�ӦʽΪ��Cu2+ + 2Br - ![]() Cu +Br2����A��ȷ��B. HCO3������ˮ�ⷴӦ����H2CO3��OH������ȷ�����ӷ���ʽΪ��HCO3����H2O
Cu +Br2����A��ȷ��B. HCO3������ˮ�ⷴӦ����H2CO3��OH������ȷ�����ӷ���ʽΪ��HCO3����H2O![]() H2CO3��OH������B����C. ���������Ũ�ȵ�Ba(OH)2ϡ��Һ��NH4HCO3ϡ��Һ��������ӷ���ʽΪ��Ba2++2OH-+NH4++HCO3 - = BaCO3��+NH3��H2O+H2O����C��ȷ��D. ��ǿ����Һ����NaClO��Fe(OH)3��Ӧ����Na2FeO4�����ӷ���ʽΪ��2Fe(OH)3+3ClO+4OH�T2FeO42+3Cl+5H2O����ǿ����Һ�в���������H+����D����ѡAC��
H2CO3��OH������B����C. ���������Ũ�ȵ�Ba(OH)2ϡ��Һ��NH4HCO3ϡ��Һ��������ӷ���ʽΪ��Ba2++2OH-+NH4++HCO3 - = BaCO3��+NH3��H2O+H2O����C��ȷ��D. ��ǿ����Һ����NaClO��Fe(OH)3��Ӧ����Na2FeO4�����ӷ���ʽΪ��2Fe(OH)3+3ClO+4OH�T2FeO42+3Cl+5H2O����ǿ����Һ�в���������H+����D����ѡAC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��������ֳ���������Ԫ�صĵ��ʣ����йػ������������ͼ��ʾ������CΪ��ɫ������DΪ���壮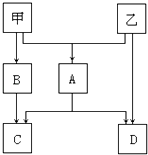
��1����DΪ�������壬��A�Ļ�ѧʽΪ ��
��2����DΪ�������壬��A+H2O��C+D��Ӧ�Ļ�ѧ����ʽΪ ��
��3�����ɼ�������Ԫ����ɵĻ�����A����ˮ�ⷴӦֻ����������C��D��������˵������ȷ���� ��
A.������A�����������ַǽ���Ԫ�����
B.C��D�������һ��ΪһԪ��
C.C��D��������һ�������ᣬһ�Ǻ�����
D.��ˮ�ⷴӦ������������ԭ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molA�����3molB������2L�������л�ϲ���һ�������·������·�Ӧ��2A��g��+B��g��2C��g����
���� 2s���� C��Ũ��Ϊ 0.6molL��1 �� �������м���˵����
��������A ��ʾ��Ӧ��ƽ������Ϊ 0.3molL��1s��1
������ B�����������40%
��2s ʱ���� A ��ת����Ϊ30%
��2s ʱ���� B ��Ũ��Ϊ 1.0molL��1
������ȷ���ǣ� ��
A.�٢�
B.�ڢ�
C.�٢�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ȡClO2�Ļ�ѧ��Ӧ��2NaClO3��SO2��H2SO4=2ClO2��2NaHSO4������˵����ȷ���ǣ� ��
A. SO2�ڷ�Ӧ��ʧȥ����B. NaClO3�ڷ�Ӧ�б�����
C. H2SO4�ڷ�Ӧ�еõ�����D. 1 mol�������ڷ�Ӧ��ʧȥ1mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ��Ӧ�����κ�ˮ�����ʾ�������
B. �����ӷ���ʽ�������Ҫ��������ʽ��ʾ
C. ���ӷ�Ӧ����������Һ�з�Ӧ������Ũ�ȼ�С�ķ������
D. Al2(SO4)3��ˮ��Һ�еĵ��뷽��ʽ��Al2(SO4)3===Al3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ
Zn��s��+ ![]() O2��g���TZnO��s����H1=��351.1kJmol��1
O2��g���TZnO��s����H1=��351.1kJmol��1
Hg��l��+ ![]() O2��g���THgO��s����H2=��90.7kJmol��1
O2��g���THgO��s����H2=��90.7kJmol��1
�ɴ˿�֪Zn��s��+HgO��s���TZnO��s��+Hg��l����H3 �� ���С�H3��ֵ�ǣ� ��
A.��441.8 kJmol��1
B.��254.6 kJmol��1
C.��438.9 kJmol��1
D.��260.4 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O ![]() ��CrO
��CrO ![]() �����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֣� ����1����ԭ������
�����ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֣� ����1����ԭ������
�÷��Ĺ�������Ϊ�ܢۢڢ�
CrO ![]()
![]() Cr2O72��
Cr2O72�� ![]() Cr3+
Cr3+ ![]() Cr��OH��3��
Cr��OH��3��
���еڢٲ�����ƽ�⣺2CrO42����ɫ��+2H+Cr2O72������ɫ��+H2O
��1����ƽ����ϵ��pH=2������Һ��ɫ��
��2����˵���ڢٲ���Ӧ��ƽ��״̬���� �� a��Cr2O ![]() ��CrO42��Ũ����ͬ
��CrO42��Ũ����ͬ
b.2v��Cr2O ![]() ��=v��CrO42��
��=v��CrO42��
c����Һ����ɫ����
��3���ڢڲ��У���ԭ1 mol Cr2O72�����ӣ���Ҫmol��FeSO47H2O��
��4���ڢ۲����ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��Cr3+��aq��+3OH����aq��
�����£�Cr��OH��3���ܶȻ�Ksp=c��Cr3+��c3��OH����=10��32 �� Ҫʹc��Cr3+������10��5 mol/L����Һ��pHӦ���� ��
����2����ⷨ
�÷���Fe���缫��⺬ Cr2O72�������Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr��OH��3������
��5����Fe���缫��ԭ��Ϊ ��
��6��������������ҺpH���ߵ�ԭ���ǣ��õ缫��Ӧ���ͣ� �� ��Һ��ͬʱ���ɵij������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪԭ���������������ǰ������Ԫ�أ�Ԫ��Aԭ���������������ڲ��3����Ԫ��B��̬ԭ�Ӻ�����2��δ�ɶԵ��ӣ�Ԫ��C����ۺ���ͼ۴����͵���0��Ԫ��Dλ�����ڱ���B�塣
��1���ж�����AB2�����ӵĿռ乹��Ϊ__________��A��B��C 3��Ԫ�ص�һ�������ɴ�С��˳��Ϊ__________________ ��������Ӧ��Ԫ�ط��ű�ʾ��
��2��Ԫ��A��C�γɵĻ������۵�ܸߣ�����B��C�γɵĻ������۵�ͣ���ԭ����_________��
��3����A���⻯�A2H4�������У�Aԭ�ӹ�����ӻ�������___________��
��4��Ԫ��B��D�γɵ�һ�ֻ�����㷺Ӧ����¼���Ŵ��ϣ��侧������ͼ��ʾ���û�����Ļ�ѧʽΪ___________��

��5����D���Ȼ���DCl3��Һ�еμӰ�ˮ���γ������[D(NH3)3(H2O)Cl2]Cl��
������D3+�ĺ�������Ų�ʽΪ_________________��
��1 mol��������к���λ������ĿΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ����ʹ�������ܷ������·�Ӧ��Ca(ClO)2��4HCl(Ũ)===CaCl2��2Cl2����2H2O��������ܾõ�Ư�ۺ�Ũ���ᷴӦ�Ƶõ������У����ܺ��е���������Ϊ��CO2 �� ��HCl����H2O����O2�е� (����)
A.�٢ڢ�
B.�ڢۢ�
C.�٢ڢۢ�
D.�٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com