
分析 Ⅰ.①草酸溶解后转移到250ml的容量瓶定容,得到所配置的溶液;
②分析反应前后元素化合价变化可知,Mn元素化合价从+7价变化为+2价,化合价降低做氧化剂,草酸中的碳元素化合价应升高,从+3价升高为+4价,所以以后产物为二氧化碳,依据电子守恒配平的离子方程式;
③步骤一是称量配制只需要一次准确操作,步骤二是滴定过程,为避免产生较大误差,滴定实验一般需要重复2-3次,所以测定操作中需要重复进行的操作是步骤二;
④依据滴定实验误差分析的依据是c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析判断;
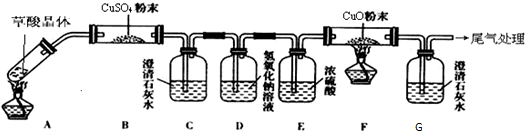
Ⅱ.①依据实验装置过程中的反应现象分析草酸分解得到产物,结合原子守恒写出化学方程式;
②发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,依据草酸损耗的因素分析判断;
③依据利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,实验设计分析,过程中产生误差的因素是生成的一氧化碳不能全部反应,试验时需要在整套装置中充满一氧化碳避免点燃时发生爆炸,草酸可能为全部分解,装置G中 液体倒流会装置F导致称量质量产生误差;
解答 解:Ⅰ.①草酸溶解后转移到250ml的容量瓶定容,配制得到所需的溶液,故答案为:250mL容量瓶;
②分析反应前后元素化合价变化可知,Mn元素化合价从+7价变化为+2价,化合价降低做氧化剂,草酸中的碳元素化合价应升高,从+3价升高为+4价,所以以后产物为二氧化碳,依据电子守恒配平的离子方程式为:2MnO4-+5H2C2O4+6H+=Mn2++10CO2↑+8H2O;
故答案为:2、5、6、2、10CO2↑、8;
③步骤一是称量配制只需要一次准确操作,步骤二是滴定过程,为避免产生较大误差,滴定实验一般需要重复2-3次,所以测定操作中需要重复进行的操作是步骤二;
故答案为:步骤二;
④A.锥形瓶瓶壁残留蒸馏水就转移入酸性KMnO4溶液进行滴定,对实验无影响,故A不符合;
B.酸式滴定管用蒸馏水洗后未用待测溶液润洗就加入待测液进行滴定,结构消耗标准液体积增大,结构偏高,故B符合;
C.滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,滴定终点后读取标准液体积增大,测定浓度偏大,故C符合;
D.滴定完成后俯视刻度,读取的标准液体积减小,结构偏低,故D不符合;
故答案为:BC;
Ⅱ.①B中CuSO4粉末变蓝,说明分解产物含有水蒸气,装置C、G中澄清石灰水变浑浊,F中CuO粉末部分变红,证明生成的产物中含有二氧化碳气体和一氧化碳气体,依据原子守恒配平写出的化学方程式为:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O;
故答案为:H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+H2O;
②发现B装置质量增量比理论值大,该小组同学认真分析断定操作无误,说明草酸在加热分解过程中变成蒸气的在装置B的玻璃管内壁凝结
故答案为:在加热时草酸部分升华在B中部分凝华;
③依据利用加热分解的草酸晶体的质量和F装置中固体质量的减少就可以计算出晶体中结晶水的含量,实验设计分析,过程中产生误差的因素是生成的一氧化碳不能全部反应,试验时需要在整套装置中充满一氧化碳避免点燃时发生爆炸,草酸可能为全部分解,装置G中 液体倒流会装置F导致称量质量产生误差;
故答案为:前面的反应装置中滞留有大量CO气体;为防止爆炸在点燃F处酒精灯之前要先通一段时间的CO以排除装置系统中的空气;装置G中的水蒸气逆流进入装置F中;加热时草酸部分升华未能全部分解.
点评 本题考查了物质性质的探究实验设计和实验现象的理解应用,掌握实验基础是解题关键,题目较为综合,题目难度中等,做题时注意抓住反应的现象,以此推断物质可能具有的性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用激光笔照射鸡蛋白水溶液 | 有丁达尔效应 | 鸡蛋白分子直径介于1nm~100nm |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 实验步骤 | 实验结果 |
| ① | 称取9.06g的结晶化合物A加热 | 加热到质量恒定时,质量减轻了4.32g; |
| ② | 将加热后所得的固体分成两等份,分别加适量的水,制成溶液. | |
| ③ | 在一份溶液中加入足量的BaCl2溶液. | 产生4.66g 白色沉淀; |
| ④ | 在另一份溶液中,逐滴加入2mol•L-1的NaOH溶液. | 先观察到产生白色沉淀,接着产生有刺激性气味的气体B,沉淀逐渐溶解,当加入25mL的氢氧化钠溶液时,沉淀恰好完全溶解. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: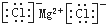 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com