
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 打开汽水瓶,看到有大量的气泡逸出 | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,故A能;
B、因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故B能;
C、增大氧气浓度平衡正向移动,可以提高二氧化硫的转化率,所以能用勒沙特列原理解释,故C能;
D、H2、I2、HI三者的平衡,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒沙特列原理解释,故D不能;
故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且符合平衡移动的原理.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
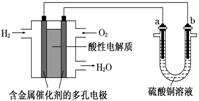
| A. | a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
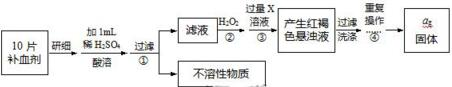
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
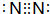 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com