
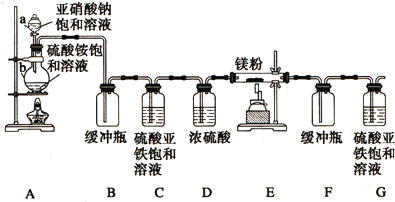
分析 (1)利用装置内气体热胀冷缩检验装置的气密性;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平书写方程式;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁;
解答 解:(1)利用装置内气体热胀冷缩检验装置的气密性,检查装置气密性的方法是:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶,
故答案为:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;分液漏斗;圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平后方程式为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O,
故答案为:2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,除去水蒸气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气,故C、D不能对调,
故答案为:除去氧气(及氮氧化物);除去水蒸气;不能,对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁,反应方程式为:N2+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2,
故答案为:N2+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
点评 本题以氮化镁的制备为载体,考查学生对实验装置的理解、元素化合物的性质、实验方案的设计等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 木炭与炽热的水蒸气反应制取水煤气 | |
| B. | 铜丝在氯气中燃烧 | |
| C. | 高温煅烧石灰石 | |
| D. | 氢氧化钡晶体与氯化铵固体混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2→MnO4- | B. | Al(OH)4-→Al(OH)3 | C. | SO32-→SO42- | D. | MnO2→MnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸溶液的物质的量浓度大于碱溶液的物质的量浓度 | |
| B. | 酸溶液中H+的浓度小于碱溶液中0H-的浓度 | |
| C. | 酸和碱混合时,碱过量 | |
| D. | 酸溶液的pH与碱溶液pH之和为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁与稀H2SO4反应 | B. | FeO与H2SO4反应 | ||
| C. | FeCO3与H2SO4稀反应 | D. | Fe(OH)3与稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:
为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{800}$mol•L-1 | B. | 1.25ρmol•L-1 | C. | $\frac{ρ}{1600}$mol•L-1 | D. | 0.63mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com