
| A. | ①>②>③ | B. | ③>①>② | C. | ③>②>① | D. | ②>①>③ |
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | X元素原子基态时的电子排布式为[Ar]4s24p3 | |
| B. | X元素是第四周期第ⅤA族元素 | |
| C. | Y元素原子的电子排布式为 | |
| D. | Z元素具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
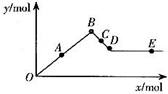 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A. | A~D时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | C~D时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | A~D时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | D~E时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 CH2-CHCl
CH2-CHCl .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
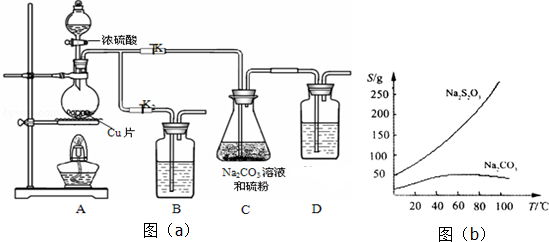
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 12种 | D. | 14种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com