
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.分析 (1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,结合反应方程式中各物质的聚集状态解答;
(2)在水溶液里只有部分电离的酸是弱酸,二元弱酸分步电离,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
(3)①25℃时,0.1mol/L的HA溶液中$\frac{C({H}^{+})}{C(O{H}^{-})}$=1010,c(OH-).c(H+)=10-14,则该溶液中c(H+)=0.01mol,根据c(HA)与c(H+)相对大小确定酸强弱;
②加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;
③等pH时,弱电解质的物质的量浓度大于盐酸的浓度,酸的物质的量越大,产生的氢气越多.
解答 解:(1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,故答案为:>;>;
(2)常温下,0.1mol/L的某酸H2A的pH=4,说明该酸部分电离,则为弱酸,H2A是二元弱酸,分步电离,第一步电离方程式为:H2A?H++HA-,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以该溶液中由水电离出的c(H+)水=c(OH-)=10-10 mol/L,
故答案为:弱;H2A H++HA-;10-10 mol/L;
H++HA-;10-10 mol/L;
(3)①25℃时,0.1mol/L的HA溶液中$\frac{C({H}^{+})}{C(O{H}^{-})}$=1010,c(OH-).c(H+)=10-14,则该溶液中c(H+)=0.01mol<0.1mol/L,所以HA是弱酸,则HA是弱电解质;
故答案为:弱电解质;
②加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A-)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大;
A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以$\frac{c({H}^{+})}{c(HA)}$ 增大,故错误;
B.加水稀释促进HA电离,n(A-)增大、n(HA)减小,溶液体积相同,所以$\frac{c(HA)}{c({A}^{-})}$ 减小,故正确;
C.温度不变,水的离子积常数不变,所以c(H+)与c(OH-)的乘积不变,故错误;
D.加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液温度不变,离子积常数不变,则溶液中c(OH-)增大,故错误;
故选B;
③等pH的HA溶液和盐酸,HA是弱酸,盐酸是强酸,所以HA的物质的量浓度大于盐酸,等体积等pH的HA和盐酸,HA的物质的量大于盐酸,所以向等体积、等pH的HA溶液和盐酸中分别加入足量Zn,产生的H2是HA多,
故答案为:多.
点评 本题考查弱电解质的电离,侧重于浓度对平衡移动的影响,溶液中离子浓度的比较,水解平衡的变化分析,溶液中的电荷守恒应用,题目难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度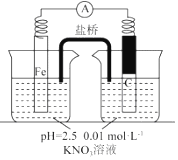 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 诜项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入浓硝酸 | 比较Fe和Cu的金属活动性 |
| D | 将铁钉放入试管中,下端浸入食盐水中 | 验证铁的吸氧腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若HA、HB均为弱酸,酸性:HA>HB,则相同条件下,溶液的pH大小为NaA>NaB | |
| B. | 相同条件下,将pH=11的NaOH溶液和和氨水分别稀释pH=9的溶液,所加水的体积前者大 | |
| C. | pH=3的醋酸与pH=1的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是:c(Na+)>c(CHCOO-)>c(OH-)>c(H+) | |
| D. | 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com