
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 实验测得:101kPa时,H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1;CH4的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,结合焓变与化学计量数成正比进行判断.
解答 解:A.燃烧热的反应中,生成产物必须是稳定的氧化物,水必须为液态,正确的反应为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.根据甲烷燃烧的热化学方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol可得:$\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15 kJ•mol-1,故B正确;
C.焓变的单位错误,应该为kJ/mol,正确的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ/mol,故C错误;
D.H2的燃烧热为285.8kJ•mol-1,则2mol氢气完全燃烧生成2mol液态水放出的热量应该为571.6kJ,正确的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,故D错误;
故选B.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握燃烧热的概念及含义,试题培养了学生的灵活应用能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
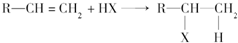
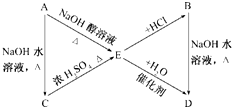
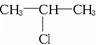 ,C:CH3CH2CH2OH,D:
,C:CH3CH2CH2OH,D: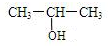 ,E:CH3CH=CH2.
,E:CH3CH=CH2. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$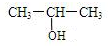 +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
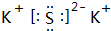 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇含有的分子数为 NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 在含1mol氢氧化铁的胶体中,胶粒数目为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 14 | C. | 15 | D. | 16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com