
已知反应:①101 kPa时,C(s)+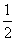 O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1
下列结论正确的是( )
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ
科目:高中化学 来源: 题型:
现有下图所示的两种分子模型,其中“●”为碳原子,“ ”为氧原子,“○”为氢原子。
”为氧原子,“○”为氢原子。

下列说法中正确的是( )
A.分子式相同,是同种物质
B.两者互为同系物
C.两者互为同分异构体
D.分子中都含有羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述正确的是 ( )。
A.CS2为V形极性分子
B.SiF4与SO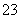 的中心原子均为sp3杂化
的中心原子均为sp3杂化
C.C2H2分子中σ键与π键的数目比为1:1
D.水加热到很高温度都难分解是因水分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________
________________________________________________________。
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为__________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为________ cm(用代数式表示)。
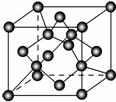
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管向其中滴加5 mL盐酸。试回答下列问题:
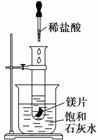
(1)实验中观察到的现象是________________________________________________________________________
________________________________________________________________________。
(2)产生上述现象的原因是________________________________________________________________________
________________________________________________________________________。
(3)写出有关反应的离子方程式:________________________________________________________________________。
(4)由实验推知,MgCl2和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25 ℃的饱和石灰水”换成“20 ℃碳酸饮料”进行实验探究,实验中观察到的另一现象是______________________________________________________,
其原因是____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
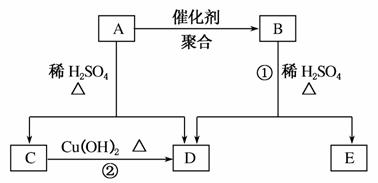
已知R—CH===CHOH(烯醇)不稳定,很快转化为R—CH2CHO。
根据以上信息回答下列问题:
(1)A的分子式为________________;
(2)反应②的化学方程式是________________________________________________________________________;
(3)A的结构简式是________________;
(4)反应①的化学方程式是________________________________________________________________________;
(5)A有多种同分异构体,写出四个同时满足(ⅰ)能发生水解反应(ⅱ)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:____________、____________、____________、____________;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在烷烃分子中的基团: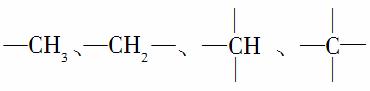 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示。例如:

分子中,N1=6,N2=1,N3=2,N4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子数N0与N1、N2、N3、N4之间的关系是N0=________________________________________________________。
(2)4种碳原子数之间的关系为N1=_______________________。
(3)若分子中N2=N3=N4=1,则该分子的结构简式可能为(任写一种)________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com