
����Ŀ��H2O2�dz��õ���ɫ��������H2S�ǻ�ԭ������H2S��Ի��������彡����������Σ����
I.H2S�ij�ȥ��������H2S��ԭ��Ϊ:H2S+Fe2(SO4)3=S��+2FeSO4+H2SO4��4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O��
2Fe2(SO4)3+2H2O��
(1)��˾�����ʱ,FeSO4����������������ʱ��5��105�����þ���������_____��
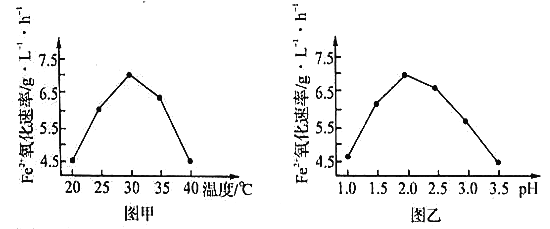
(2)��ͼ��ͼ���ж�������˾����������Ϊ_______������������£��÷�Ӧ�ļ��ȷ�ʽΪ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����__________��
II.Ϊ�о������������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ���������һϵ�е�ʵ�顣��������������Һ�ֱ����A��B��C��D�ĸ���Ӧƿ�У��ռ����������壬�ڹ���������:
ʵ����Һ | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3��Һ | 0 | 1.0 | 2.0 | V1 |
30%H2O2��Һ | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)ʵ����������¼��������___________��
(2)�ϱ��е�V2=_______��V3=_________��
���𰸡� ���� 30�桢pH=2 ˮԡ���� �¶ȹ��ߣ���˾�ʧȥ���ԣ�ʧȥ�˴����ã���Ӧ�����½� ��ͬʱ�����ռ��������� �� �ռ���ͬ�������������Ҫ��ʱ�� 20.0 16.0
��������I.(1)��Ӧ4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O����˾�����ʱ,FeSO4����������������ʱ��5��105������˸þ������������������ͷ�Ӧ�Ļ�ܣ�(2)��ͼ���з�����֪��ʹ����˾�������������������������������ʱ����Ҫ���¶Ⱥ���ҺpH�ֱ�Ϊ��30�桢pH=2.0������������£��÷�Ӧ�ļ��ȷ�ʽΪˮԡ���ȣ���Ӧ�¶ȹ��ߣ���Ӧ�����½�����Ϊ����ʹ�����ʷ������ԣ�����ʧȥ�������ԣ�
2Fe2(SO4)3+2H2O����˾�����ʱ,FeSO4����������������ʱ��5��105������˸þ������������������ͷ�Ӧ�Ļ�ܣ�(2)��ͼ���з�����֪��ʹ����˾�������������������������������ʱ����Ҫ���¶Ⱥ���ҺpH�ֱ�Ϊ��30�桢pH=2.0������������£��÷�Ӧ�ļ��ȷ�ʽΪˮԡ���ȣ���Ӧ�¶ȹ��ߣ���Ӧ�����½�����Ϊ����ʹ�����ʷ������ԣ�����ʧȥ�������ԣ�
II.(1)�о������������Թ�������ֽ����ʵ�Ӱ�죬��Ҫ��¼�ռ���ͬ������������ʱ�䣨����ͬʱ�����ռ�������������(2)�о������������Թ�������ֽ����ʵ�Ӱ�죬��������Ҫ��ͬ��������ÿ��ʵ����������ͬ����B�еó���Һ�������Ϊ38.0mL������V2=20.0mL��V3=16.0mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�У��йء�H�ıȽ���ȷ���ǣ� �� ��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H1CH4��g��+2O2��g���TCO2��g��+2H2O��l����H2
��NaOH��aq��+ ![]() H2SO4��Ũ���T
H2SO4��Ũ���T ![]() Na2SO4��aq��+H2O��l����H3
Na2SO4��aq��+H2O��l����H3
NaOH��aq��+CH3COOH��aq���TCH3COONa��aq��+H2O��l����H4 ��
A.��H1����H2����H3����H4
B.��H1����H2����H3����H4
C.��H1=��H2����H3����H4
D.��H1����H2����H3����H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�����������������ȷ���ǣ� ��
A.1L 0.5molL��1��ˮ������NH4+��Ϊ0.5NA
B.1mol Fe������������Ӧת�Ƶĵ�����Ϊ2 NA
C.��״���£�33.6LCO2Լ����1.5NA������
D.1 mol ![]() �к�̼̼˫����Ϊ3 NA
�к�̼̼˫����Ϊ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������飨C8H10�����������ϵ��屽��ϩ��C8H8�����䷴Ӧԭ����C8H10��g��C8H8��g��+H2��g����H��0 ��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ������������ʵ������õ��������±���
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n��C8H10��/mol | 0.40 | 0.30 | 0.26 | n2[��Դ��] | n3 |
n��C8H8��/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������ ��
��2�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ���� ��
��ѧ�� | C��H | C��C | C=C | H��H |
����/kJmol1 | 412.5 | 348 | 612 | 436 |
��3����֪�� ����������Ӧ�ġ�H=kJmol��1 �� �����������������䣬��0.40mol H2��g����0.40mol C8H8��g���ϳ�C8H10��g��������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������ �� ��ʱ���÷�Ӧ�Ƿ�ﵽ��ƽ��״̬������ǡ�����
��ҵ���Ը���ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ��������뷴Ӧ����C8H10��g����ƽ��ת������ˮ��������������ϵ���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ͼ����ʾ��
��4����ͼ���֪��T1T2������ڡ�����С�ڡ����ڡ�����
��5����ͼ���֪����������������ʱ��ˮ����������Խ��C8H10��ƽ��ת���ʽ����Խ����ԽС�����䡱����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������һ����Ҫ�Ļ��������м�����Ҫ�ɷ���Fe3O4��Fe2O3��FeO�Ͷ�������ȣ��������������������Ʊ���Ч��ˮ���ۺ�������������ͼ��
��1��ʵ����ʵ�֡�����I�����õIJ��������������ձ���
��2�����顰���ܡ������Һ�к���Fe2+�Լ��� �� ������ ��
��3��������III��ϵ�в�����������Ϊ�������˺�ϴ�ӣ�ϴ�ӵķ����� ��
��4����������H2O2��Ŀ��������Fe2+ �� д��H2O2����Fe2+ΪFe3+�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϣ���500��600�����м��ͨ������������ˮ�Ȼ������������м��ͨ���Ȼ���������ˮ�Ȼ�������������ͼ��ʾ��װ��ģ���������̽������飮�ش��������⣺ 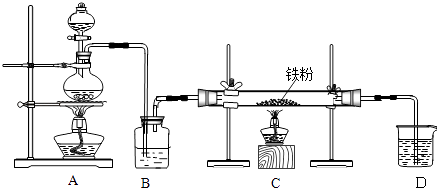
��1����ȡ��ˮ�Ȼ�����ʵ���У�A�з�Ӧ�Ļ�ѧ����ʽΪ �� װ��B�м�����Լ��� ��
��2����ȡ��ˮ�Ȼ�������ʵ���У�װ��A������ȡ �� β���ijɷ��� �� ������D��װ�ý���β�����������ڵ��������� ��
��3���������������Ƶõ�FeCl2 �Ậ������FeCl3 �� ����FeCl3���õ��Լ��� �� ���Ƶô�����FeCl2 �� ��ʵ�������Ӧ�ȵ�ȼ���ľƾ��ƣ�Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1molC��H����Ҫ��������414.4kJ������1mol C��C����Ҫ��������347.4kJ������1mol C�TC������ų�����615.3kJ������1mol H��H������ų�����435.3kJ��ij�л���ֽ�ķ�Ӧ�ɱ�ʾΪ�� 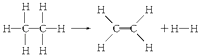
���ڷ�Ӧ��������1mol���飨��Ӧ������йظ÷�Ӧ��˵����ȷ���ǣ� ��
A.�÷�Ӧ�ų�251.2 kJ������
B.�÷�Ӧ����251.2 kJ������
C.�÷�Ӧ�ų�125.6 kJ������
D.�÷�Ӧ����125.6 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ε�������ij����Һ�����ֵ��������ȳ�����������ܽ⣮������Һ�ǣ�������
A. ϡ���� B. ��������þ��Һ C. �Ȼ�����Һ D. �����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ������������ȷ���ǣ� �� 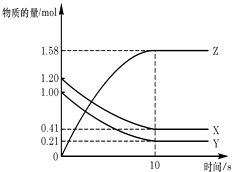
A.��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158mol/��Ls��
B.��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79mol/L
C.��Ӧ��ʼ��10sʱ��Y��ת����Ϊ79.0%
D.��Ӧ�Ļ�ѧ����ʽΪ��X��g��+Y��g��Z��g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com