
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2Cr2O7溶液,发生的两个化学反应为:SO2+2Fe3++2H2O=SO42—+2Fe2++W ①
Cr2O72—+aFe2++bH+―→Cr3++Fe3++H2O ②。
下列有关说法正确的是( )。
A.还原性:Cr3+>SO2
B.方程式②中,a=6,b=7
C.Cr2O72—能将Na2SO3氧化成Na2SO4
D.方程式①中W为OH-
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
下列说法符合绿色化学思想的是( )。
A.对工业生产硝酸产生的废气、废水进行严格处理
B.利用根瘤菌固氮以减少氮肥生产厂
C.实验室制备NO2时在通风橱内进行
D.生产硫酸的工厂种草、种树,使其成为“花园式工厂”
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(解析版) 题型:填空题
(1)甲醇是一种重要的化工产品,可利用甲醇催化脱氢制备甲醛。甲醛与气态甲醇转化的能量关系如图所示。

反应过程中的能量关系
①甲醇催化脱氢转化为甲醛的反应是________(填“吸热”或“放热”)反应。
②过程Ⅰ与过程Ⅱ的反应热是否相同?____________原因是__________________________________。
③写出甲醇催化脱氢转化为甲醛的热化学反应方程式________________________________。
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+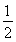 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是________。

A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物的总能量
C.根据②推知反应:CH3OH(l)+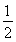 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
D.反应②的能量变化如图所示
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/10-12 m | 160 | 110 | 70 | 66 |
主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是( )。
A.离子半径:W<X
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
有一澄清透明溶液,含有H+、Fe3+、Fe2+、Al3+、AlO2—、CO32—、NO3—中的几种,向溶液中逐滴加入1 mol·L-1 NaOH溶液,开始没有沉淀生成,后产生沉淀,沉淀达到最大量后继续滴加NaOH溶液时沉淀部分消失。下列判断正确的是 ( )。
A.一定不含Fe3+和Fe2+
B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C.溶液可能含有NO3—
D.一定含有Fe3+,一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:填空题
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量的浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl- 和Br- 的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为______________________________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第2讲化学常用计量练习卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是( )。
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH4+
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:

图1
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·
L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。

图2
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图1分离方法称为________法。
(2)步骤2中有一处明显不合理的是___________________________________。
趁热过滤的理由是________________________________________________。
(3)步骤3加热浓缩过程中,当________时停止加热。用无水乙醇洗涤晶体的原因是______________________________________________________________。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:填空题
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com