
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+ B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出 D.若溶液中有Fe2+,则一定有Cu析出
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
下列对有机高分子的叙述,正确的是( )
A.原子与原子、链节跟链节均以共价键结合
B.原子跟原子以共价键结合,链节跟链节以分子间作用力结合
C.原子跟原子、链节跟链节均以非极性共价键结合
D.原子跟原子以非极性共 价键结合,链节跟链节以极性共价键结合
价键结合,链节跟链节以极性共价键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为__________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成+1价阳离子,每个该离子中的电子数是________,元素Z的最高价含氧酸的稀溶液与金属银反应的离子方程式为_______________________________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式
_____________________________________________________________________;
元素X的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式____________________________。
(5)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是________(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一未完成的离子方程式________+XO +6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
+6H+===3X2+3H2O,据此判断,氧化产物和还原产物的物质的量之比为 ( )
A.1∶1 B.3∶1
C.5∶1 D.7∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
铬是人体必需 的微量元素,它
的微量元素,它 与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是 ( )
与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是 ( )
A.发生铬中 毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O +I-+H+—→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2
+I-+H+—→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O
查看答案和解析>>
科目:高中化学 来源: 题型:
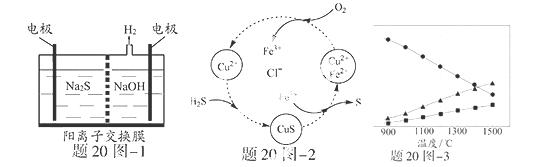
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池 的阳极区进行电解。电解过程中阳极
的阳极区进行电解。电解过程中阳极
区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化 得到硫单质,其离子方程式可写成 。
得到硫单质,其离子方程式可写成 。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
适用相关化学知识进行判断,下列结论正确的是
A.某吸热反应能自发进行,则该反应的△S>0
B.SO2使酸性KMnO4溶液褪色,因此SO2具有漂白性
C.在物质分离的方法中,蒸馏、萃取、重结晶都与物质的溶解度有关
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能加快生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液可能含Cl-、CO32-、SO32-、Na+、SO42-、Al3+、Fe2+、将少量溶液滴在蓝色石蕊试纸上,试纸变红。另取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,同时有气体产生,再取上层清液滴加硝酸银溶液,产生白色沉淀,下列判断合理的是
A.一定有Cl- B.一定有SO42-、Fe2+
C.一定没有Al3+、SO32- D.一定没有CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
现用质量分数为98%、密度为1.84 g · cm-3的浓H2SO4来配制480mL0.2 mol/L的稀H2SO4。请回答下列问题:
(1)在配制稀H2SO4时用到的玻璃仪器有玻璃棒、烧杯 、量筒还有 ; 。
(2)经计算,需浓H2SO4的体积为 。
现有①10 mL ②50 mL ③100 mL三种规格的量筒,应选用的量筒是 (填代号)。
(3) 在配制过程中,其他操作都准确,下列操作中会造成硫酸物质的量浓度偏高的有
(填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水稀释浓H2SO4
③转移前,容量瓶中含有少量蒸馏水
④未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com