
 .
.| 物质 | 电离常数(Ka) |
| HCN | Ka=5×10-10 |
| H2CO3 | Ka1=4.5×10-7 Ka2=4.7×10-11 |

分析 (1)①根据原子的最外层电子数来分析电子式,并注意离子的电子式书写应用中括号和带电荷数,共价化合物不用中括号,氨气有3个氢原子和1个氮原子分别共用1对电子形成;
②一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸,结合原子守恒配平书写化学方程式;
(2)图表中酸的电离平衡常数大小为H2CO3>HCN>HCO3 -,酸越弱对应盐水解程度越大,碱性强溶液PH越大;
(3)①I.HCN(g)+3H2(g)?NH3(g)+CH4(g)△H1
Ⅱ.HCN(g)+H2O(g)?NH3(g)+CO(g)△H2
结合盖斯定律计算Ⅰ-Ⅱ得到反应Ⅲ,CO(g)+3H2(g)?CH4(g)+H2O(g)的△H;
②HCN(g)+H2O(g)?NH3(g)+CO(g)反应为气体体积不变的反应,减小压强平衡不变;
③I.HCN(g)+3H2(g)?NH3(g)+CH4(g)K1=$\frac{c(C{H}_{4})c(N{H}_{3})}{c(HCN){c}^{3}({H}_{2})}$
Ⅱ.HCN(g)+H2O(g)?NH3(g)+CO(g)K2=$\frac{c(N{H}_{3})c(CO)}{c(HCN)c({H}_{2}O)}$
反应ⅢCO(g)+3H2(g)?CH4(g)+H2O(g)K=$\frac{c(C{H}_{4})c({H}_{2}O)}{c(CO){c}^{3}({H}_{2})}$,
K=$\frac{{K}_{1}}{{K}_{2}}$,K1=10-15,K2=10-5,据此计算得到lgK;
(4)CNO-在阳极上失电子发生氧化反应生成氮气、二氧化碳和水;
解答 解:(1)①氨气有3个氢原子和1个氮原子分别共用1对电子形成,电子式为: ,故答案为:
,故答案为: ;
;
②一定的温度和催化剂作用下,利用甲烷、氨气为原料氧化合成氢氰酸和水,结合原子守恒配平书写化学方程式为:2CH4+2NH3+3O2$\frac{\underline{\;一定条件\;}}{催化剂}$2HCN+6H2O,
故答案为:2CH4+2NH3+3O2$\frac{\underline{\;一定条件\;}}{催化剂}$2HCN+6H2O;
(2)图表中酸的电离平衡常数大小为H2CO3>HCN>HCO3 -,酸越弱对应盐水解程度越大,25℃时,物质的量浓度均为0.1mol•L-1的NaCN、NaHCO3和Na2CO3三种溶液,溶液PHNa2CO3 >NaCN>NaHCO3,其pH最大的是Na2CO3 ,
故答案为:Na2CO3 ;
(3)①I.HCN(g)+3H2(g)?NH3(g)+CH4(g)△H1
Ⅱ.HCN(g)+H2O(g)?NH3(g)+CO(g)△H2
结合盖斯定律计算Ⅰ-Ⅱ得到反应Ⅲ,CO(g)+3H2(g)?CH4(g)+H2O(g)的△H=(△H1-△H2 )KJ/mol,
故答案为:△H1-△H2 ;
②HCN(g)+H2O(g)?NH3(g)+CO(g)反应为气体体积不变的反应,减小压强平衡不变,HCN的转化率不变,
故答案为:不变;
③I.HCN(g)+3H2(g)?NH3(g)+CH4(g)K1=$\frac{c(C{H}_{4})c(N{H}_{3})}{c(HCN){c}^{3}({H}_{2})}$
Ⅱ.HCN(g)+H2O(g)?NH3(g)+CO(g)K2=$\frac{c(N{H}_{3})c(CO)}{c(HCN)c({H}_{2}O)}$
反应ⅢCO(g)+3H2(g)?CH4(g)+H2O(g)K=$\frac{c(C{H}_{4})c({H}_{2}O)}{c(CO){c}^{3}({H}_{2})}$,
K1=10-15,K2=10-5,K=$\frac{{K}_{1}}{{K}_{2}}$=10-10,lgK=10,
故答案为:10;
(4)电解法处理含氰废水的原理如图乙所示,阳极CN-先发生电极反应:CN-+2OH--2e-═CNO-+H2O,CNO-在阳极上进一步氧化的电极反应式为,2CNO-+4OH--6e-=N2↑+2CO2↑+2H2O,
故答案为:2CNO-+4OH--6e-=N2↑+2CO2↑+2H2O;
点评 本题考查了弱电解质电离平衡、盐类水解原理的应用、电离平衡常数计算、原电池电解反应书写、热化学方程式书写等知识点,掌握基础是解题关键,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A极为负极,电子从铂电极流向该极 | |
| B. | Pt电极上发生还原反应 | |
| C. | Ag-Pt电极发生的反应是:2NO3-+6H2O+10e-═N2↑+12OH- | |
| D. | 电解一段时间后,两地减少的质量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 ;装置a中的试剂是浓硫酸.
;装置a中的试剂是浓硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$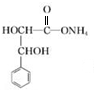 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 或
或 . (任写一种)
. (任写一种) ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和CO | B. | CO2和N2O | C. | O3和CO2 | D. | CO32-和NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com