
(8分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。

(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”、“小于”、“等于”或“无法确定”),若二者恰好反应所得溶液的pH<7,原因是__________________。(用离子方程式表示)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=________。
(8分)(1) 10:1(2分);(2)a+b=14 (2分)
(3)小于(1分);B- + H2O BOH + H+(1分);(4)10(2分)
BOH + H+(1分);(4)10(2分)
【解析】
试题分析:(1)25℃时, pH=9的NaOH溶液,c(OH-)=10-5mol/L;pH=4的H2SO4溶液混合,c(H+)=10-4mol/L;若所得混合溶液的pH=7,n(OH-)=n(H+)。则c(OH-)?V(NaOH)= c(H+)?V(H2SO4)。故NaOH溶液与H2SO4溶液的体积比为V(NaOH):V(H2SO4)= c(H+):c(OH-)=10:1;(2)95℃时,水的离子积常数是Kw=10-13.若100体积pH=a的某强酸溶液中n(H+)=100×10-amol=10(2-a)mol, 1体积pH=b的某强碱溶液n(OH-)=10-12÷10-b=10(b-12)mol。混合后溶液呈中性,10(2-a)mol=10(b-12)mol。2-a=b-12.所以a+b=14。(3)曲线A所对应的温度是室温。在室温下,pH=2的HCl溶液,c(H+)(水)=10-12mol/L;pH=11的某BOH溶液中,c(H+)(水)=10-11mol/L;水电离产生的H+的浓度越大,水的电离程度就越大。若水的电离程度分别用α1、α2表示,则α1<α2。若二者恰好反应所得溶液的pH<7,说明该盐是强碱弱酸盐,弱碱阴离子B-发生水解反应消耗水电离产生的H+,最终使溶液中c(H+)>c(OH-),水解的离子方程式是:B- + H2O BOH + H+;(4)曲线B所对应的温度是95 ℃,该温度下水的离子积常数是Kw=10-12,在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,则反应后溶液中c(OH-)=0.02mol÷2L=0.01mol/L。由于该温度下水的离子积常数是Kw=10-12,所以c(H+)=10-10,所得混合液的pH=10。
BOH + H+;(4)曲线B所对应的温度是95 ℃,该温度下水的离子积常数是Kw=10-12,在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,则反应后溶液中c(OH-)=0.02mol÷2L=0.01mol/L。由于该温度下水的离子积常数是Kw=10-12,所以c(H+)=10-10,所得混合液的pH=10。
考点:考查酸碱中和反应时溶液的体积比、盐的水解、溶液的pH的计算的知识。


科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)
M(结构简式: )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。

已知︰
完成下列填空:
50.写出反应类型。 反应①_____________ 反应⑦_____________
51.写出结构简式。 A_________________ D__________________
52.写出检验E已完全转化为M的方法_______________________________。
53.写出一种满足下列条件C的同分异构体的结构简式(不考虑立体异构)___________。
i.能发生银镜反应
ii.无环状结构
iii.分子中有2种化学环境不同的氢原子
54.完成以C3H6为有机原料制备丙酸(CH3CH2COOH)(其他无机原料任选)的合成路线。
(合成路线的常用表示方法为: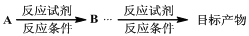 )
)
55.反应③的目的是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
向饱和澄清石灰水中加入少量CaC2,充分反应后立即测定所得溶液中离子浓度,下列预测正确的是
A.c(Ca2+)、c(OH―)一定增大 B.c(Ca2+)、c(OH―)一定保持不变
C.c(Ca2+)、c(OH―)均可能减小 D.c(OH―)增大、c(H+)减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为 ,其中心原子采取 杂化;化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)Z原子基态时的外围电子排布式为 ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为 。

(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
某醇在适当条件下与足量的乙酸发生酯化,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是
A.该醇分子中一定具有甲基 B.该醇分子中一定没有甲基
C.该醇分子中至少含有三个碳原子 D.该醇分子中具有两个醇羟基
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(10分)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y单质晶体熔点高硬度大。试回答下列问题:
(1)五种元素中原子半径最大的元素是__________(写元素符号)
(2)X与M两元素以原子个数1:1形成的化合物的电子式为____________________
(3)写出由YM2制取Y单质的化学方程式____________________
(4)化合物Z 2 W 2遇水剧烈反应,产生黄色沉淀和刺激性气味的气体,其反应的化学方程式为____________
(5)W、M两元素形成的单质和化合物常用来杀菌消毒,试举例__________(写化学式,任写两种)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列解释事实的离子方程式不正确的是
A.酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O
B.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列判断中,正确的是
A.H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子
B.SO2和CO2都属于酸性氧化物,Na2O和A12O3都属于碱性氧化物
C.在氯化铵水溶液中,既存在水解平衡,又存在电离平衡
D.O2在放电的条件下生成O3属于化学变化,电解质溶液导电属于物理变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关 的说法中正确的是
的说法中正确的是
A.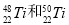 原子中均含有22个中子
原子中均含有22个中子
B. 为同一核素
为同一核素
C.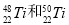 互称同位素,在周期表中位置相同,都在第4纵行
互称同位素,在周期表中位置相同,都在第4纵行
D.分别由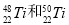 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com