
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl36H2O)的工艺流程如图: 
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 . 该反应的化学方程式 , 该反应中被氧化的元素是 .
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、;
(3)操作a为蒸发浓缩、冷却结晶、、、干燥,获得FeCl36H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
0.1 | 0.5 | 1 | 10 | |
400 | 99.2% | 99.6% | 99.7% | 99.9% |
500 | 93.5% | 96.9% | 97.8% | 99.3% |
600 | 73.7% | 85.8% | 89.5% | 96.4% |
根据表中的数据判断该反应的正向属于(填“放热“或”吸热“)反应,理由是 .
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
【答案】
(1)增大反应物的接触面积,提高原料的利用率;4FeS2+11O2 ![]() 2Fe2O3+8SO2;S和Fe
2Fe2O3+8SO2;S和Fe
(2)提高铁元素的浸出率;抑制Fe3+水解
(3)过滤;洗涤
(4)放热;压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热
(5)7894.7
【解析】解:黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有亚铁离子、铁离子的盐溶液,向其中通入氯气,能将亚铁离子氧化为铁离子,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体.(1)煅烧时粉碎硫铁矿的目的是增大接触面积增大反应速率,提高原理利用率;依据流程可知反应物为FeS2和氧气,生成物为二氧化硫和氧化铁,反应的方程式为:4FeS2+11O2 ![]() 2Fe2O3+8SO2 , 反应中铁元素化合价+2价升高为+3价,所以贴元素被氧化,硫元素从﹣1价变化为+4价,化合价升高失电子被氧化,被氧化的元素为Fe和S;所以答案是:增大反应物的接触面积,提高原料的利用率;4FeS2+11O2
2Fe2O3+8SO2 , 反应中铁元素化合价+2价升高为+3价,所以贴元素被氧化,硫元素从﹣1价变化为+4价,化合价升高失电子被氧化,被氧化的元素为Fe和S;所以答案是:增大反应物的接触面积,提高原料的利用率;4FeS2+11O2 ![]() 2Fe2O3+8SO2;Fe和S;(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解,所以答案是:提高铁元素的浸出率;抑制Fe3+水解;(3)操作a为由溶液获得晶体需加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl36H2O,所以答案是:过滤;洗涤;(4)由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应,
2Fe2O3+8SO2;Fe和S;(2)酸溶及后续过程中均需保持盐酸过量,其目的是使氧化铁溶解为氯化铁,抑制铁离子的水解,所以答案是:提高铁元素的浸出率;抑制Fe3+水解;(3)操作a为由溶液获得晶体需加热蒸发浓缩、冷却结晶、过滤、洗涤、干燥,获得FeCl36H2O,所以答案是:过滤;洗涤;(4)由表中数据可知,压强一定时,温度升高时,SO2的转化率降低,说明升高温度有利于平衡向逆反应移动,故正反应为放热反应,
所以答案是:放热;压强一定时,温度升高,SO2转化率下降,说明升温平衡逆向移动,则正向放热;(5)反应的关系式为:FeS2~2SO2~2SO3~2H2SO4 ,
设生产1万吨98%硫酸所需要含80% FeS2质量为x,反应过程中硫的损失率为5%,硫元素利用率95%,
FeS2 | ~ | 2SO2 | ~ | 2SO3 | ~ | 2H2SO4 |
120 | 196 | |||||
x×80%×95% | 1×104t×98% |
x×80%×95% 1×104t×98%
x= ![]() =7894.7t,
=7894.7t,
所以答案是:7894.7.


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1
B.4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C.3I2+6KOH ![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
D.2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HCl属于共价化合物,溶于水能电离出H+和Cl-
B. HI气体受热分解的过程中,只需克服分子间作用力
C. NaOH是离子化合物,该物质中只含离子键
D. 液态HCl能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 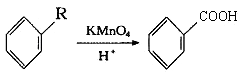 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.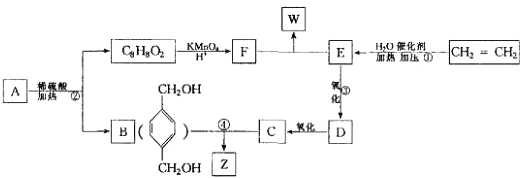
回答下列问题:
(1)写出反应类型:① , ② .
(2)写出化学反应方程式: ③
④
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为 ![]() , ,
, ,
(4)A的结构简式可能为(只写一种即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有下列物质:①铜;②石灰水;③CO2;④Na2SO4固体;⑤CaO.其中属于混合物的是(填序号,下同),属于碱性氧化物的是;写出Na2SO4在水溶液中的电离方程式: .
(2)如图装置中仪器①的名称是 , 水流的方向是从(填“a”或“b”)口进入. 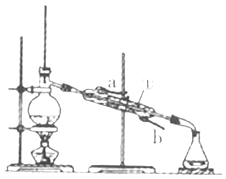
(3)实验室常用(填试剂)检验Fe3+的存在,现象是 .
(4)19g MgCl2中Mg2+的物质的量是mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( ) 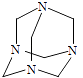
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
(1)3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关13C、15N的叙述正确的是
A. 13C与15N有相同的中子数 B. 13C与C60互为同位素
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com