
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素 | |
| D. | M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
分析 A.由基态成为激发态,吸收能量;
B.Cr原子最外层为半充满结构;
C.最外层为第5层,价电子数为4;
D.M层全充满而N层为4s1的原子的核外电子排布为1s22s22p63s23p63d104s1,为铜位于第四周期第IB族的原子.
解答 解:A.镁原子由1s22s22p63s2→1s22s22p63p2时,电子能量增大,应吸收能量,故A错误;
B.24Cr原子的电子排布式是1s22s22p63s23p63d54s1,故B错误;
C.最外层为第5层,价电子数为4,位于第五周期IVB族元素,故C正确;
D.M层全充满而N层为4s1的原子的核外电子排布为1s22s22p63s23p63d104s1,为铜位于第四周期第IB族的原子,和位于第四周期第ⅠA族的原子不是同一种元素,故D错误.
故选C.
点评 本题考查了电子排布式、周期和族的判断、化合价与电子排布的关系等,为高频考点,题目难度不大,侧重于考查学生的分析能力和应用能力,注意根据电子排布尤其是价电子排布判断元素的性质.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 烧瓶中的溶液呈红色,则原气体一定是SO2 | |
| B. | 烧瓶中的溶液呈蓝色,则原气体可能是NH3 | |
| C. | 形成喷泉的原因是烧瓶内压强大于外界大气压 | |
| D. | 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;F含有的官能团名称是羧基、羟基.
;F含有的官能团名称是羧基、羟基. .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
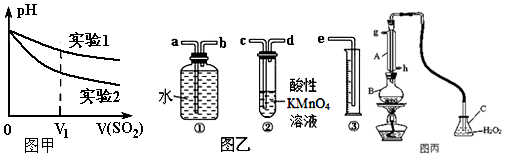
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O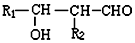
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO. .
. .
. (写一种).
(写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com