
A.0.011 mol·L-1 B.0.22 mol·L-1
C.0.022 mol·L-1 D.0.11 mol·L-1
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:黑龙江省哈六中2012届高三上学期期末考试化学试题 题型:022
A、B、C三种短周期元素在周期表中相对位置如图:
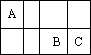
(1)A与C形成的液态化合物是常见的重要有机溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:________>________>________(用化学式表示).
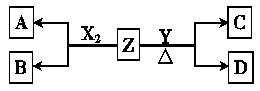
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17 g·L-1.Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol·L-1 Z水溶液pH=13.X、Y、Z有如图转化关系:
①写出X与Z反应的离子方程式:________.
②已知丙能与稀硫酸反应生成能使品红褪色的气体.丁的化学式为________,丁的水溶液pH>7的原因是:________(用离子方程式表示).
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色.写出反应的离子方程式________.
查看答案和解析>>
科目:高中化学 来源:湖北省襄阳五中2012届高三上学期期中考试化学试题 题型:022
有A、B、C、D四种短周期元素在周期表中相对位置如下图:
(1)A与D形成的液态化合物是常见的重要有机溶剂,
则A、B、C、D四种元素最高价氧化物对应的水化物酸
性由强到弱的顺序是:________>________>________>________(用化学式表示),B、C、D三种元素的第一电离能由大到小的顺序是:________(用元素符号表示)
(2)X、Y为C、D两种元素形成的单质.标准状况下,X的密度为3.17 g/L.Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol/L Z水溶液pH=13.X、Y、Z有如图转化关系:
①写出X与Z反应的离子方程式:________
②已知丙能与稀硫酸反应生成使品红褪色的气体.丁的化学式________,丁的水溶液pH>7的原因:________(用离子方程式表示)
③将20 mL 0.5 mol/L丙溶液逐滴加入20 mL 0.2 mol/L KMnO4溶液(硫酸酸化)中,恰好褪色.写出反应的离子方程式________.
查看答案和解析>>
科目:高中化学 来源:北京市昌平区2011届高三二模理综化学试题 题型:058
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
![]()
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:

(1)步骤Ⅰ的目的是除不溶性杂质.所需操作的名称是________.
(2)步骤Ⅱ的目的是除硫酸亚铁.操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①写出用H2O2溶液除去硫酸亚铁的离子方程式________.
②调整pH的范围应该在________之间.
(3)步骤Ⅲ的目的是得到CuSO4·5H2O晶体.操作是将溶液加热蒸发至有晶膜出现时,停止加热,________,水浴加热烘干.采用水浴加热的原因是________.
(4)该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入2 mL 5% H2O2溶液,再向H2O2溶液中分别滴入0.1 mol·L-1 FeCl3和CuSO4溶液各1 mL,摇匀,观察到滴入FeCl3溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确________(填正确或错误),请说明原因________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如下图(其他无关物质已略去)。请回答下列问题:
| 单质X2 | 标准状况下密度为3.17 g?L-1 |
| 单质Y | 通常状况下为一种淡黄色固体 |
| 化合物Z | 焰色反应呈紫色(透过蓝色钴玻璃观察) |
| 常温下0.1 mol?L-1 Z的水溶液pH=13 |
(1) Z的电子式为 。
(2)已知16 g固态单质Y在空气中完全燃烧放出148 kJ热量,则该反应的热化学方程式为 。
(3)已知C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①常温下D的水溶液pH>7,其原因是(用离子方程式表示) 。
②将20 mL 0.5 mol?L-1 C溶液逐滴加入20 mL 0.2 mol?L-1 KMnO4溶液(硫酸酸化)中,溶液恰好变为无色。写出该反应的离子方程式: 。
(4)①用石墨和铁作电极,在隔膜电解槽中电解A的溶液,阳极产生X2,电解A溶液的离子方程式为 。
②实验室常用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(石墨和铁作电极,温度为42~44 ℃)电解A的溶液生产化合物E。假设电解时电解槽进液口溶液中A 的浓度为2 mol?L-1,液口溶液中A的浓度为1.6 mol?L-1(进出口流量相同),则液口溶液中E的浓度为
mol?L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如右图(其他无关物质已略去)。请回答下列问题:
| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1 mol·L-1的水溶液pH=13 |
(1)用化学方程式表示X2在工业生产上的一种用途 。
(2) 比较元素X与Y的氢化物稳定性: 比 稳定(填氢化物化学式)。
(3)将0.24 mol Y氧化物YO2和 0.11 mol氧气放入容积为1 L的密闭容器中,一定条件下反应达到平衡,得到0.12 mol YO3气体,同时放出热量11.8kJ。
①该反应平衡常数= 。
②该反应的热化学方程式为 。
(4) C能与稀硫酸反应生成能使品红溶液褪色的气体,D中所含阴、阳离子的电子层排布相同。
①写出Y与Z反应的离子方程式
②将20 mL 0.5 mol·L-1 C溶液逐滴加入到V mL 0.2 mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪色(此时Mn元素恰好变为Mn2+)。计算V= 。
(5)用石墨作电极,在隔膜电解槽中电解A的溶液,可制得Z的水溶液,请写出甲烷燃料电池(Z的水溶液为电解质溶液)负极的电极反应式

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com