
【题目】50mL 0.55molL﹣1盐酸与50mL 0.50molL﹣1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 .
(2)从装置图上看除了缺少一种玻璃仪器外,还有一处不妥的是: .
(3)若实验中改用50mL 0.55molL﹣1醋酸溶液进行反应,与上述实验相比,所放出的热量(填“减少”“不变”“增多”);
(4)若实验改用25mL 0.55molL﹣1硫酸与25mL 0.50molL﹣1Ba(OH)2溶液代替上述反应,所求得的中和热△H (填“偏大”“偏小”“无影响”).
(5)已知:Q=cm△t,如果盐酸和NaOH溶液的密度均为1gcm﹣3 , 反应后混合溶液的比热容c=4.18J(g℃)﹣1 . 实验数据如表:根据上表中所测数据,通过计算得到中和热△H=kJ/mol(保留一位小数).
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
① | 20.3 | 20.3 | 23.6 |
② | 20.3 | 20.3 | 23.7 |
③ | 20.3 | 20.3 | 25.9 |
④ | 20.3 | 20.3 | 23.8 |
(6)下列操作能引起△H偏大的是:(填序号)操作.
①大烧杯上不盖硬纸板
②用环形铜丝搅拌棒搅拌反应混合溶液
③分多次把NaOH溶液倒入装盐酸的小烧杯中.
【答案】
(1)环形玻璃搅拌棒
(2)碎纸条未填满,大小烧杯杯口未相平
(3)减小
(4)偏小
(5)﹣56.8
(6)①②③
【解析】解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
所以答案是:环形玻璃搅拌棒;
(2)为减少热量散失,应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满,
所以答案是:碎纸条未填满,大小烧杯杯口未相平;
(3)醋酸是弱电解质,电离要吸热,所放出的热量偏小;
所以答案是:减少;
(4)氢氧化钡与硫酸反应生成了硫酸钡沉淀,放出热量,中和热的数值偏大,但求得的中和热△H偏小,
所以答案是:偏小;
(5)第1次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.6℃,反应前后温度差为:3.3℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.7℃,反应前后温度差为:3.4℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:25.9℃,反应前后温度差为:5.6℃;
第4次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.8℃,反应前后温度差为:3.5℃;
第3次实验误差较大,舍去,温度差平均值为3.4℃;
50mL 0.55molL﹣1盐酸与50mL 0.50molL﹣1NaOH溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量为:1.4212kJ,所以生成1mol的水放出热量为1.4212kJ× ![]() =﹣56.8kJ/mol,即该实验测得的中和热△H=﹣56.8kJ/mol,
=﹣56.8kJ/mol,即该实验测得的中和热△H=﹣56.8kJ/mol,
所以答案是:﹣56.8;
(6)①大烧杯上如不盖硬纸板,会使一部分热量散失,中和热的数值偏小,但中和热△H偏大,故①正确;
②铜丝导热性良好,热量损失多,中和热的数值偏小,但中和热△H偏大,故②正确;
③分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失较多,中和热的数值偏小,但中和热△H偏大,故③正确;
所以答案是:①②③.


科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,加入2molA和1molB发生反应:2A(g)+B(g) ![]() 3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
3C(g)+D(g)达到平衡时,C的浓度为amol/L.若维持容器体积和温度不变,按下列四种配比为起始物质,达平衡后,C的浓度仍为amol/L的是( )
A.4molA + 2mol B
B.2molA + 1molB + 3molC + 1molD
C.3molC + 1molD + 1molB
D.3molC + 1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是

A. a极为直流电源的负极,与其相连的电极发生还原反应
B. 阴极得到2mol电子时,通过阳离子交换膜的H+为2mol
C. 吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
D. 阳极发生的反应式为SO2+2e-+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

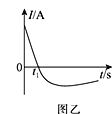
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 蛋白质是由C、H、O、N四种元素组成的物质
B. 硝基乙烷(CH3CH2NO2)与甘氨酸(氨基乙酸)互为同分异构体
C. 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D. 合成高聚物![]() 的单体是
的单体是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HSO4溶液中,离子浓度由大到小的顺序正确的是
A. c(NH4+)>c(SO42-)>c(H+)>c(OH-) B. c(H+)>c(SO42-)> c(NH4+)> c(OH-)
C. c(SO42-)> c(NH4+)> c(H+)> c(OH-) D. c(SO42-)> c(NH4+)> c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组测定镁、铝合金中镁的质量分数。甲小组同学称量3.9g合金按照下图进行实验。

(1)仪器A的名称是_________。
(2)检查装置气密性的方法是_________。
(3)检查装置气密性好后开始实验,滴加稀硫酸时开始没有气泡产生,你认为可能的原因是____。
(4)若测得气体的体积是4.48L(转化为标准状况下),则合金中镁的质量分数是_______,若读数时没有冷却到室温读数,测得合金中镁的质量分数_____(填写“偏大”或“偏小”)。
(5)下列实验方案中能测定镁的质量分数的是_________。
A.W1gMg、Al合金量![]() 固体→洗涤、干燥称量质量为W2g
固体→洗涤、干燥称量质量为W2g
B.W1gMg、Al合金![]() 固体→洗涤、干燥称量质量为W2g
固体→洗涤、干燥称量质量为W2g
C. W1gMg、Al合金![]() 排水量气测得气体体积为V2L(转化为标况)
排水量气测得气体体积为V2L(转化为标况)
D.W1gMg、Al合金![]() 溶液
溶液![]() 沉淀→洗涤、干燥称量质量为W2g
沉淀→洗涤、干燥称量质量为W2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com