
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ���
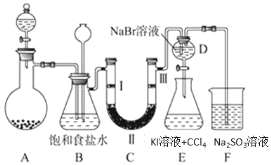
��1��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C���������������η�______
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | ��ˮ�Ȼ��� | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��2�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ��һ����������ʱ�����Կ�����ɫ��Һ��Ϊ�Ȼ�ɫ����������װ��D��������Һ����װ��E�У����۲쵽���������²���Һ����ɫ����֤�����嵥�ʵ�������ǿ�ڵⵥ�ʣ�������ͬѧ�Ըý���������飬����������___________��
��3���ձ�F�е� ����������Һ��������β�������ʵ�鷽����֤β�����պ���Һ�к��� SO42-_____��
���𰸡�d Dװ�����ܽ��˹�����Cl2��Cl2��I��������I2 ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42��
��������
��1������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�������ӷ�����Ӧ��ȡ�������к����Ȼ��⣬װ��B�б���ʳ��ˮ�������dz�ȥCl2�е�HCl��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ���֤�����Ƿ����Ư���ԣ�Ҫ��֤����������Ư���ԣ�ʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abcd�Ģ��ж��Ǹ��������ͨ��ʪ�����ɫ����������֤������Ư���ԣ�����C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd����2��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԣ�D�з���������NaBr�ķ�Ӧ�����壬��������װ��D��������Һ����װ��E�У��������������KI��Ӧ���ɵ⣬��E�е����������Ȼ�̼��������Һ�ֲ㣬�ϲ�ӽ���ɫ���²㣨���Ȼ�̼�㣩Ϊ�Ϻ�ɫ����������˵����ķǽ�����ǿ�ڵ⣬��Ϊ����������Ҳǿ�ڵ⣬����������Ҳ�ɽ���������������3���������������Ʒ�Ӧ�����Ȼ��ƺ������ƣ���ѧ����ʽ��Cl2+2Na2SO3=2NaCl+Na2SO4, ȡ����F�е���Һ������������ϡ���ᣬ�ټ���B aCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42����
(1)�������������֪��Ҫ���������Ƿ����Ư���ԣ���Ҫ��֤����������Ư���ԣ�ʪ��������Ư���ԣ�����Ϊʪ�����ɫ�����У�������ˮ��Ӧ���ɴ��������Ư���ԣ�ѡ����abcd�Ģ��ж��Ǹ�����������������ü�ʯ�Ҹ����a��ѡ����ͨʪ�����ɫ��������b��ѡ��������ȷ��˳������C��I��II��III���η���ʪ�����ɫ��������ˮ�Ȼ��ơ��������ɫ����������ѡd���𰸣�d��
��2��D��Eʵ���Ŀ���DZȽ��ȡ��塢��ķǽ����ԣ�D�з���������NaBr�ķ�Ӧ�����壬��������װ��D��������Һ����װ��E�У��������������KI��Ӧ���ɵ⣬��E�е����������Ȼ�̼��������Һ�ֲ㣬�ϲ�ӽ���ɫ���²㣨���Ȼ�̼�㣩Ϊ�Ϻ�ɫ����������˵����ķǽ�����ǿ�ڵ⣬��Ϊ����������Ҳǿ�ڵ⣬����������Ҳ�ɽ��������������𰸣�Dװ�����ܽ��˹�����Cl2��Cl2��I��������I2��
��3���������������Ʒ�Ӧ�����Ȼ��ƺ������ƣ���ѧ����ʽ��Cl2+2Na2SO3=2NaCl+Na2SO4, Ҫ����ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42�����𰸣�ȡ����F�е���Һ������������ϡ���ᣬ�ټ���BaCl2��Һ��ϡ������BaCl2��Һ˳����Ե�������������ɫ����֤������SO42����


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д� �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ��ɫ���壬��ṹ��ͼ��ʾ�������й�˵������ȷ���ǣ� ��
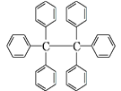
A. ����һ�ֱ���ͬϵ��������л��ܼ���
B. ���ķ���ʽΪC38H30��ֻ���зǼ��Լ�
C. ���ķ���������ԭ�ӹ�ƽ��
D. �˴Ź���������3���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ſ�ѧ�����ķ�չ�ͻ���Ҫ��IJ�����ߣ�CO2�IJ������ü�����Ϊ�о����ص㡣���������գ�
��1��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2��g��+4H2��g��![]() CH4��g��+2H2O��g������֪H2������������¶ȵ����߶����ӣ����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ����������������С��������������
CH4��g��+2H2O��g������֪H2������������¶ȵ����߶����ӣ����¶ȴ�300������400�棬���´ﵽƽ�⣬�ж����б����и��������ı仯����ѡ����������������С��������������
v�� | v�� | ƽ�ⳣ��K | ת������ |
________ | ________ | ________ | ________ |
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�����±���
[CO2]/molL��1 | [H2]/molL��1 | [CH4]/molL��1 | [H2O]/molL��1 | |
ƽ��� | a | b | c | d |
ƽ��� | m | n | x | y |
a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ________��
��3��̼�H2CO3 �� K1=4.3��10��7 �� K2=5.6��10��11 ���H2C2O4 �� K1=5.9��10��2 �� K2=6.4��10��5 ,0.1mol/LNa2CO3��Һ��pH____0.1mol/LNa2C2O4��Һ��pH����ѡ������������С��������������������Ũ�ȵIJ�����Һ��̼����Һ�У�������Ũ�Ƚϴ����___��
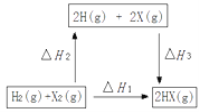
��4������ͼ��ת����ϵ��(X����±��)����H2_____0(������������������������)����H1����H2�͡�H3���ߴ��ڵĹ�ϵΪ_______��
��5������Ũ�Ⱦ�Ϊ0.1mol��L-1��������Һ�������ᡢ�ڴ��ᡢ���������ơ��ܴ����ơ���ش��������⣺
�ٴ������и�����Ũ���ɴ�С��˳����_______��
�ڴ���ʹ����Ƶ�������������Һ�У�c(CH3COOH)��c(CH3COO��)��______mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ������ؿ���������Ⱦ���������������ѭ�������ʣ�װ����ͼ��ʾ������˵������ȷ����
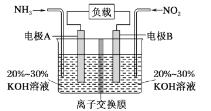
A.�缫A����ӦʽΪ2NH3��6e����N2��6H��
B.Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C.����4.48LNO2(��״��)������ʱ��ת�Ƶ���Ϊ0.8mol
D.�õ�ؼ���ʵ����Ч��������������ŷţ����ܳ�����û�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�NaOH��Һ�ζ����������(�������Ka1��12��10��2��Ka2��63��10��8)��Һ���ζ���������Һ����Ե��������仯������ͼ��ʾ������b��Ϊ��Ӧ�յ㡣���������������
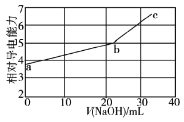
A.b��Ļ����ҺpH�����ܵ���7
B.����Ũ�Ⱥ������Ӱ����Һ�ĵ�������
C.C��Ļ����Һ�У�c(OH��)��c(Na��)��c(K��)
D.Na����SO32���ĵ�������֮�ʹ���HSO3���ĵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��M��Ϊ������Ԫ�أ�M��һ�ֺ��ز������ӣ�X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ��Yԭ������������Ϊ�ڲ��������3��������˵������ȷ����
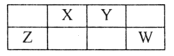
A. ԭ�Ӱ뾶��Z��X��Y��M
B. X��Y��Z��W��M�����γ�18���ӷ���
C. X��Y��M�γɵĻ�����ˮ��Һһ��������
D. Y�ļ������ӻ�ԭ������X�ļ������ӻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1��д���������ʵĵ���ʽ��Na2O2_____NH3_____��
��2��2.2g笠�14N2H4+����������___�������������____��ij������һ��ԭ�Ӻˣ������� 17�����ӣ�20�����ӣ������� 18�����ӣ������ӵĻ�ѧ������____��
��3����֪�Ͽ� 1mol H��H ����1mol I��I ����1mol H��I ���ֱ���Ҫ���յ�����Ϊ 436kJ��151kJ��299kJ������ 1mol H2�� 1mol I2���� 2mol HI��_____(���ų�������������)_____kJ ��������
��4�������������ʣ���H2 ��Na2O2 ��NaOH ��H2O2 ��CaCl2 ��NH4NO3 ��H2S��ֻ�����Ӽ����ɵ�������_____(����ţ�ͬ��)�������Ӽ����ۼ����ɵ�������_________�����ڹ��ۻ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪCaF2��H3BO3(��״�ṹ�����ڵ�H3BO3����ͨ��������)������ͭ���־���Ľṹʾ��ͼ����ش��������⣺

��1��ͼ����ʾ��CaF2��������Ca2+����ҵȾ����F����Ϊ_______��ͼ����δ��ŵ�ͭԭ���γɾ������Χ����ڵ�ͭԭ����Ϊ_______��
��2�����־������۵���͵���________���侧�������ۻ�ʱ���˷�����֮��������Ϊ________��
��3�����CaF2����ľ���ʾ��ͼ����֪���������������Ca2+�˼����Ϊa��10��8 cm������CaF2������ܶ�Ϊ________g��cm��3����ȷ��С�����һλ����NA�þ������ִ���ȥ���㣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��Co��Ni��Ϊ�ڢ���Ԫ�أ����ǵĻ����������������������Ź㷺��Ӧ�á�
(1)��̬Coԭ�ӵļ۵����Ų�ʽΪ________��Co2������3d�ܼ�����________�ԳɶԵ��ӡ�
(2)Co3����һ��������[Co(N3)(NH3)5]2���У�Co3������λ����________��1 mol�������������Ҽ�����ĿΪ____________����λ��N3������ԭ�ӵ��ӻ�����Ϊ____________��
(3)Co2����ˮ��Һ����[Co(H2O)6]2�����ڡ���Co2������Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2������ԭ����__________________________��
(4)ij��ɫ�����У�Fe2����Fe3���ֱ�ռ�������廥�����ڵĶ��㣬���������ÿ�����Ͼ���һ��CN����K��λ���������ijǡ��λ���ϡ��ݴ˿�֪�þ���Ļ�ѧʽΪ________����������Fe2�������������γɵĿռ乹����________��
(5)NiO�ľ����ṹ��ͼ����ʾ������ԭ���������AΪ(0,0,0)��BΪ(1,1,0)����Cԭ���������Ϊ________��
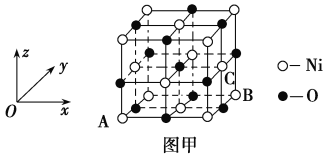
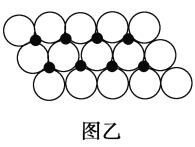
(6)һ���¶��£�NiO��������Է��ط�ɢ���γɡ������Ӳ㡱��������ΪO2��Ϊ���õ������У�Ni2���������(��ͼ��)����֪O2���İ뾶Ϊa pm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ_____g(�ú�a��NA�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com