
Cu+基态核外电子排布式为
________________________________________________________________________。
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向100 mL 0.1 mol·L-1的FeSO4溶液中加入0.01 mol Na2O2固体:2Fe2++2Na2O2+2H2O===4Na++2Fe(OH)2+O2↑
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO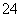 恰好沉淀完全:2Al3++3SO
恰好沉淀完全:2Al3++3SO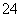 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
C.在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3·H2O+SO2===NH +HSO
+HSO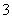
D.向20 mL 0.5 mol·L-1 FeBr2溶液中通入448 mL Cl2(标准状况):2Fe2++4Br-+3Cl2===2Fe3++6Cl-+2Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第6周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3
C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的ΔH=100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能小100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: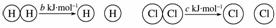
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为(a+b+c)kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com