
【题目】为验证浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,设计如下实验:

(1)写出浓硫酸与木炭粉反应的化学方程式_____________。
(2)B中加入的试剂是_____,现象是______;C的作用是____,E的作用是________。
(3)如果将F放在B、C之间,则一定不能检出的物质是_______。
【答案】C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O无水硫酸铜固体由白色变为蓝色验证SO2的存在检验SO2是否被除干净CO2
CO2↑+2SO2↑+2H2O无水硫酸铜固体由白色变为蓝色验证SO2的存在检验SO2是否被除干净CO2
【解析】本题考查化学实验中实验设计的评价,(1)利用浓硫酸的强氧化性,与木炭反应的方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O ;(2)实验目的是验证木炭与浓硫酸反应产物,从反应方程式中得出产物是CO2、SO2、H2O,先验证水蒸气的存在,一般用无水CuSO4,白色变为蓝色,说明产生水,SO2能能使品红褪色,利用SO2的漂白性,因此C的作用是验证SO2的存在,SO2也能使澄清石灰水变浑浊,必须除去,同时验证是否除尽,因此装置E的作用是验证SO2是否被除净;(3)SO2也能使澄清石灰水变浑浊,CO2不能使品红或酸性高锰酸钾溶液褪色,因此F在B、C之间不能检出CO2.
CO2↑+2SO2↑+2H2O ;(2)实验目的是验证木炭与浓硫酸反应产物,从反应方程式中得出产物是CO2、SO2、H2O,先验证水蒸气的存在,一般用无水CuSO4,白色变为蓝色,说明产生水,SO2能能使品红褪色,利用SO2的漂白性,因此C的作用是验证SO2的存在,SO2也能使澄清石灰水变浑浊,必须除去,同时验证是否除尽,因此装置E的作用是验证SO2是否被除净;(3)SO2也能使澄清石灰水变浑浊,CO2不能使品红或酸性高锰酸钾溶液褪色,因此F在B、C之间不能检出CO2.


科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
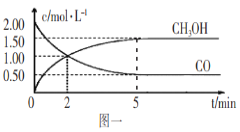
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,回答下列问题。
I、向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色。该反应的离子方程式为__________;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是________。
II、工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
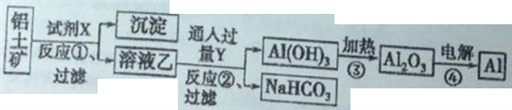
回答下列问题:
(1)上述反应是否都是氧化还原反应_________(填“是”或“否”);写出反应①的化学方程式_____。
(2)反应①后过滤的沉淀为_______,简述确定此物质中金属元素及其价态的操作过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿伏加德罗常数(NA),下列说法不正确的是
A. 1mol氮气和NA个一氧化碳分子的质量相等
B. NA个O2分子和NA个O3分子的质量相等
C. NA个O2和NA个H2的质量比为16∶1
D. 质量同为16g的O2、O3中都含有的氧原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是
A. 该合成中所有的电能和热能全部转化为化学能
B. 该合成氨过程不属于氮的固定
C. 空气、水、太阳能均为可再生资源
D. 断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.1g镁铝合金溶于70ml4mol/L硫酸中,当合金完全溶解后,再加入70ml8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为
A. 0.2mol B. 0.25mol C. 0.3mol D. 0.35mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用硫铁矿石(主要成分FeS2)在沸腾炉中焙烧,经过一系列反应,得到硫酸,焙烧后的矿渣用于炼铁。其转化过程如下图所示(部分条件、反应物和产物已略去):
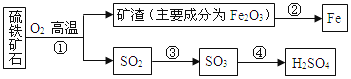
请回答下列问题:
(1)在上面转化过程中,硫元素被氧化的反应是________(填反应编号)。
(2)写出反应②中炼铁的化学方程式_____________。若用1000t含杂质28%的矿渣炼铁,理论上可得到含铁96%的生铁质量为_____________ t.
(3)写出反应①的化学方程式 ,若有12.0g FeS2参加反应,则发生转移的电子数为 。
(4)烟气中SO2的排放会造成酸雨,工业上常用Na2SO3溶液来吸收SO2以减少对环境的危害。
①常温下,将SO2通入一定体积的1.0mol·L-1Na2SO3溶液中,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,此时溶液中c(SO32-)的浓度是0.2mol·L-1,则溶液中c(HSO3-)是 mol·L-1。用化学平衡原理解释此时溶液显酸性的原因 。
②向①中pH约为6时的吸收液中通入足量O2充分反应。取反应后溶液10mL与10mLBaCl2溶液混合,欲使混合时能生成沉淀,所用BaCl2溶液的浓度不得低于 mol·L-1。[已知25℃时,Ksp(BaSO3)=5.48×10-7, Ksp(BaSO4)= 1.08×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,1g氢气燃烧生成液态水,放出142.9kJ热量,能表示H2燃烧热的热化学方程式为( )
A.2H2(g)+O2(g)==2H2O(1) △H=―571.6kJ/mol![]()
B.2H2(g)+O2(g)==2H2O(1) △H=+571.6kJ/mol
C.H2(g)+![]() O2(g)==H2O(g) △H=―285.8kJ/mol
O2(g)==H2O(g) △H=―285.8kJ/mol
D.H2(g)+![]() O2(g)==H2O(1) △H=―285.8kJ/mol
O2(g)==H2O(1) △H=―285.8kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com