
 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.分析 (1)利用元素的化合价变化来分析氧化产物与还原产物,然后分析物质的量的关系;再利用氧化还原反应中转移的电子数来计算1mol高氯酸铵分解转移的电子数;
(2)假设金属的质量都是m,根据热化学方程式的意义来计算即可;根据金属燃烧反应的特点以及应用来判断;
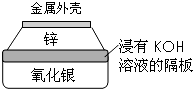
(3)①根据银锌电池工作时,负极区是金属锌失电子的氧化反应,正极上是氧化银得电子的还原反应来回答判断;
②新型锂离子电池是一种二次电池,放电时,电池是将化学能转化为电能,负极为Li,LiFeSiO4为正极,充电时为电解池,电极反应为原电池中反应的逆过程,放电时,阳离子向正极移动,阴离子向负极移动,据此分析.
解答 解:(1)在该反应中氮元素、氧元素的化合价升高,氯元素的化合价降低,则氮气和氧气为氧化产物,HCl为还原产物,由方程式可知,氧化产物的物质的量为2+5=7mol,则还原产物的物质的量为4mol,则氧化产物与还原产物的物质的量之比7:4;在该反应中4mol高氯酸铵分解转移的电子数为4×(7-(-1))=32mol,则每分解1mol高氯酸铵转移的电子为8mol,故答案为:4:7;8mol;
(2)假设金属的质量都是m,则mg金属铝完全燃烧,提供能量是$\frac{m△{H}_{1}}{4×27}$,mg金属Fe完全燃烧,提供能量是$\frac{m△{H}_{2}}{3×56}$,则相同质量的铝和铁完全燃烧,铝提供能量和铁提供能量的比值是:$\frac{14△{H}_{1}}{9△{H}_{2}}$,即则相同质量的铝和铁完全燃烧,铝提供能量是铁提供能量的$\frac{14△{H}_{1}}{9△{H}_{2}}$倍;
a.大多数即使农户燃烧产物是氧化物,金属燃烧较易控制金属燃烧后产物,减少对环境的污染,故正确;
b.镁可以与二氧化碳的反应产生氧化镁和碳单质,产生热量,达到既节能又减碳的效果,故正确;
c.将金属加工为纳米金属时,表面积增大,可以提高燃烧速率,使之更容易燃烧,故正确;
d.电解法冶炼镁铝的技术比较成熟,制取的镁铝燃烧不能用于发电,造价太高,故错误.
故选d.
故答案为:$\frac{14△{H}_{1}}{9△{H}_{2}}$,d;
(3)①银锌电池工作时,负极区是金属锌失电子的氧化反应,Zn+2OH--2e-=Zn(OH)2,消耗氢氧根离子,所以溶液的pH减小,正极是氧化银得电子的还原反应:Ag2O+2e-+H2O=2Ag+2OH-;故答案为:减小;Ag2O+2e-+H2O=2Ag+2OH-;
②充电时阳极上发生的反应为Li2SiO4-e-═LiFeSiO4+Li+,则毎生成1molLiFeSiO4转移1mol电子,阳离子向阴极移动,放电时,Li+向正极移动,故答案为:正极;1mol.
点评 本题考查学生热化学方程式的有关计算、原电池和电解池的工作原理以及氧化还原反应中电子转移的计算等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. |  如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 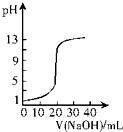 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 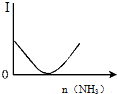 如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 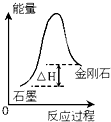 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 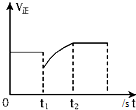 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
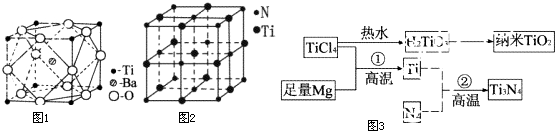
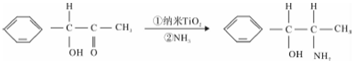
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 是碱 | B. | Na2C03 是盐 | C. | Na2C03是钠盐 | D. | Na2CO3是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com