
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与5molH2发生反应 | |
| B. | 1mol胡椒酚最多可与4mol溴发生反应 | |
| C. | 胡椒酚中所有原子可以共平面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
分析 分子中含有酚羟基,可发生取代、氧化和颜色反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.分子中含有苯环和1个碳碳双键,则1mol胡椒酚最多可与4mol氢气发生反应,故A错误;
B.分子中含有1个酚羟基,有2个邻位氢原子可被取代,且碳碳双键可与溴发生加成反应,则1mol胡椒酚最多可与3mol溴发生反应,故B错误;
C.结构简式中含有亚甲基,不可能共面,故C错误;
D.胡椒酚中含有烃基碳原子数多于苯环的碳原子数,为憎水基,则胡椒粉在水中的溶解度小于苯酚在水中的溶解度,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考查,侧重于学生的分析能力的考查,注意把握有机物的结合特点和官能团的性质,为解答该题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和液溴在FeBr3催化作用下生成溴苯 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2的反应 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油是不可再生能源,天然气是可再生能源 | |
| B. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| C. | 热值指在一定条件下,1mol的物质完全燃烧所放出的热量 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
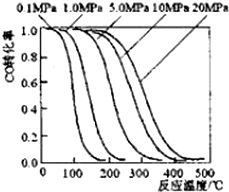 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氢气作还原剂,铝作氧化剂 | B. | B2H6充分燃烧生成B2O3和H2O | ||
| C. | B2H6中存在共价键和离子键 | D. | 每生成1molB2H6转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子总数 | B. | 摩尔质量 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
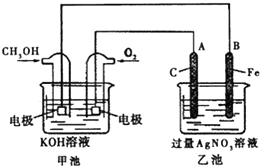 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com