
分析 V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物M的水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物T可使品红溶液褪色,可推知W为S元素,T为SO2;V是一种历史悠久、应用最广泛的金属元素,则V为Fe元素,据此解答.
解答 解:V、W、X、Y、Z是原子序数依次递减的五种常见元素.X元素是地壳中含量最多的元素,则X为O元素;Y、Z组成的气态化合物M的水溶液呈碱性,可推知Y为N元素、Z为H元素,M为NH3;W的单质在X2中燃烧产物T可使品红溶液褪色,可推知W为S元素,T为SO2;V是一种历史悠久、应用最广泛的金属元素,则V为Fe元素.
(1)Y为N元素,在周期表中的位置是:第二周期第ⅤA族;化合物H2O2可以用作消毒剂、氧化剂、漂白剂,
故答案为:第二周期第ⅤA族;消毒剂或氧化剂或漂白剂;
(2)由以上五种元素两两组合所形成的化合物中,有一种物质能与水反应生成气体且反应属于氧化还原反应,应是二氧化氮与水反应生成硝酸与NO,该反应的化学方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)O、N、H三种元素可组成一种强酸U为HNO3,氨气在适当条件下被HNO3吸收生成NH4NO3,该盐的水溶液中NH4+离子水解:NH4++H2O?NH3.H2O+H+,破坏水的电离平衡,溶液呈酸性,溶液pH小于7,
故答案为:小于;NH4++H2O?NH3.H2O+H+;
(4)将Fe投入到盐酸溶液中,生成了浅绿色FeCl2溶液,双氧水具有强氧化性,酸性条件下将亚铁离子氧化为铁离子,同时生成水,FeCl2的酸性溶液与双氧水反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(5)300mL 1mol•L-1的NaOH的物质的量=1mol/L×0.3L=0.3mol,标准状况下4.48LCO2的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,所以氢氧化钠和二氧化碳反应方程式为:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解沉淀大于碳酸氢根离子水解程度,所以c(HCO3-)>c(CO32-),由于水解程度较小,所以c(CO32-)>c(OH-),故溶液中各离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(6)以N2、H2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,正极发生还原反应,氮气在正极获得电子,酸性条件下生成NH4+,该电池的正极电极反应式为:N2+8H++6e-=2NH4+,放电时溶液中H+向正极移动,
故答案为:N2+8H++6e-=2NH4+;正.
点评 本题考查结构性质位置关系应用,涉及元素化合物性质、盐类水解、原电池等,题目难度中等,推断元素的种类是关键,理解掌握电极反应式的书写与离子浓度大小比较.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
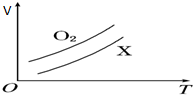 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH中氢离子结构示意图: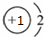 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: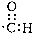 | D. | 对-硝基甲苯的结构简式: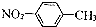 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
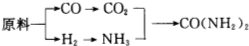
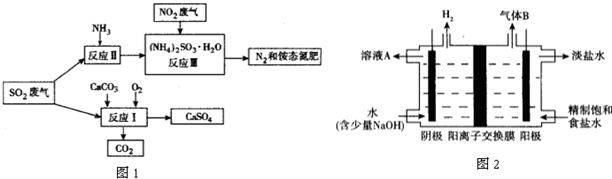
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L 醋酸中含有CH3COO-数目等于0.1NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 1 L 0.1 mol•L-1 Na2CO3溶液中含碳微粒总数一定为0.1NA | |
| D. | 1 L 0.1 mol•L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙呈红色的溶液中:Fe2+、Na+、ClO-、SO42- | |
| B. | 在PH=3的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=10-13mol•L-1的溶液中:Na+、SO32-、AlO2-、Br- | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、K+、NO3-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入石蕊试液显蓝色的溶液中:K+、Na+、HSO3-、ClO- | |
| B. | 0.1mol/L的Fe(NO3)3溶液中:Na+、H+、Cl-、I- | |
| C. | 0.1mol/L的NaAlO2溶液中:K+、H+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
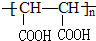 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com