

分析 (1)煅烧硫铁矿时发生反应:FeS2+O2-→Fe2O3+SO2,结合原子守恒和电子守恒配平书写化学方程式,结合定量关系计算;
(2)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②800℃时,混合气体中CO2体积分数为40%时,图象分析可知Fe2O3用CO还原得到氧化亚铁和一氧化碳;
③a、由图可知,FeO在C区稳定,对应的温度高于570℃;
b、对于反应II知,升高温度时,CO2%减小,即升温平衡逆向移动,FeO转化成Fe3O4,Fe%减小,Fe%含量由高到低为:Fe>FeO>Fe3O4>Fe2O3;
c、分离CO2可使四个反应的平衡均正向移动;
(3)①FeS;O4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应生成二硫化亚铁,利用元素守恒和电子守恒写出;
②原电池原理可知,负极是Li失电子发生氧化反应,FeS2得到电子生成硫离子和铁,该反应可认为分两步进行:第1步,FeS2+2Li═2Li++FeS22-,负极反应式为Li-e-=Li+,用总反应减去第1步反应得,2Li+FeS22-=Fe+2Li++2S2-,用该反应减去负极反应式,消去Li+即可得正极反应式的第2步电极反应式.
解答 解:(1)FeS2中铁元素由+2价升高到+3价,硫元素由-1价升高到+4价,FeS2共升高11价,O2共降低2×2=4价,配平得4FeS2 +11O2=2Fe2O3+8SO2,根据“11O2~8SO2”知,生成20 mol SO2时,消耗O2为11×20/8=27.5mol配平的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,当产生448L(标准状况)SO2时物质的量=$\frac{448L}{22.4L/mol}$=20mol,消耗O2的物质的量为27.5mol,
故答案为:27.5 mol;
(2)①、3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g);△H1=a kJ•mol-1
②、Fe3O4(s)+CO(g)═3FeO(s)+CO2(g);△H2=b kJ•mol-1
③、FeO(s)+CO(g)═Fe(s)+CO2(g);△H3=c kJ•mol-1
①依据盖斯定律计算(①+2×②+6×③)×$\frac{1}{3}$得到反应的热化学方程式:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)的△H=$\frac{(a+2b+6c)}{3}$KJ/mol,
故答案为:$\frac{(a+2b+6c)}{3}$;
②800℃时,混合气体中CO2体积分数为40%时,由图可知,“800℃、CO2体积分数为40%”时,在C区,此时为FeO的稳定区域,故产物为FeO,Fe2O3用CO还原得到氧化亚铁和一氧化碳,反应的化学方程式为:Fe2O3+CO$\frac{\underline{\;800℃\;}}{\;}$2FeO+CO2,
故答案为:Fe2O3+CO$\frac{\underline{\;800℃\;}}{\;}$2FeO+CO2;
③a、由图可知,FeO在C区稳定,对应的温度高于570℃,故a正确;
b、Fe%含量由高到低为:Fe>FeO>Fe3O4>Fe2O3,对于反应II知,升高温度时,CO2%减小,即升温平衡逆向移动,FeO转化成Fe3O4,Fe%减小,所以含量不仅与T有关,还与CO气体的比例有关,故b错误;
c、分离CO2可使四个反应的平衡均正向移动,有利于Fe含量的增加,故c正确,
故答案为:ac;
(3)①FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应生成二硫化亚铁,反应的化学方程式,FeSO4+Na2S2O3+S+H2O═FeS2↓+H2SO4+Na2SO4,反应的离子方程式为:Fe2++S2O32-+S+H2O$\frac{\underline{\;200℃\;}}{\;}$FeS2+2H++SO42-,
故答案为:Fe2++S2O32-+S+H2O$\frac{\underline{\;200℃\;}}{\;}$FeS2+2H++SO42-;
②原电池反应为FeS2+4Li═Fe+4Li++2S2-.原电池原理可知,负极是Li失电子发生氧化反应,FeS2得到电子生成硫离子和铁,该反应可认为分两步进行:第1步,FeS2+2Li═2Li++FeS22-,负极反应式为Li-e-=Li+,用总反应减去第1步反应得,2Li+FeS22-=Fe+2Li++2S2-,用该反应减去负极反应式,消去Li+即可得正极反应式的第2步电极反应式为FeS22-+2e-=2S2-+Fe,
故答案为:FeS22-+2e-=2S2-+Fe.
点评 本题考查了热化学方程式书写,原电池原理分析,化学平衡的应用,主要是图象分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s时N2的转化率为40% | |
| B. | 2s时混合气体中n(N2):n(H2):n(NH3)=3:9:4 | |
| C. | 2s时NH3的浓度为0.4mol•L-1 | |
| D. | 用N2浓度的减少表示的平均反应速率为0.2mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③④ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +218kJ/mol | B. | -109kJ/mol | C. | 218kJ | D. | 109kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
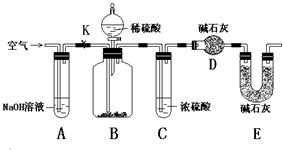 纯碱中常含有少量NaCl杂质.甲同学用下面的装置测定n g纯碱中Na2CO3的质量分数.其实验步骤:
纯碱中常含有少量NaCl杂质.甲同学用下面的装置测定n g纯碱中Na2CO3的质量分数.其实验步骤:| 实验中所发生反应的 化学方程式 | 实验所用主要仪器 (用编号表示) | 实验需直接测定的有关物理量(用文字说明) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,如果产生白色沉淀,则一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中加盐酸酸化的BaCl2,如果产生白色沉淀,则一定有SO${\;}_{4}^{2-}$ | |
| C. | 先加入盐酸,若无沉淀产生,再加入Ba(NO3)2溶液,若产生白色沉淀,则有SO${\;}_{4}^{2-}$ | |
| D. | 先加入盐酸,若无明显现象,再加入BaCl2溶液,若产生白色沉淀,则有SO${\;}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com