
| A. | 加热氯酸钾 | B. | 加热氯酸钾和二氧化锰 | ||
| C. | 加热高锰酸钾 | D. | 加热双氧水 |
分析 实验室制备氧气可以利用氯酸钾加入二氧化锰催化剂加热分解生成氯化钾和氧气,也可以加热高锰酸钾固体分解生成锰酸钾、二氧化锰和氧气,加热过氧化氢分解生成水和氧气,或过氧化氢加入催化剂二氧化锰等不需加热分解生成氧气,据此制备方法分析选项反应的条件难易.
解答 解:A.氯酸钾加热到熔融才开始慢慢分解生成氧气,速率慢,需要加热的温度高;
B.加热氯酸钾和二氧化锰,二氧化锰催化作用,在温度较低条件下分解,反应速率快;
C.加热高锰酸钾固体,分解温度低,反应速率大;
D.过氧化氢受热易分解,反应速率快,
上述分析可知制备氧气最难的是加热氯酸钾固体分解制备氧气,
故选A.
点评 本题考查了实验室制备氧气的方法和反应条件分析判断,注意知识积累,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中Ca2+数目不变 | B. | 溶液中c(Ca2+)增大 | ||
| C. | 溶液pH值增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
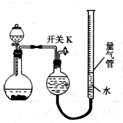 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu、稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s)、浓氨水 | NH3 | |
| Ⅲ | 过氧化钠、水 | O2 | H2O |
| Ⅳ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
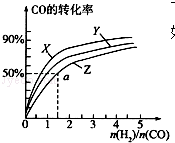 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=4.2×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 等物质的量浓度的四种酸溶液中,pH最大的是亚硫酸 | |
| B. | 等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 | |
| C. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═$CO_3^{2-}$+2HClO | |
| D. | 醋酸与NaHSO3溶液反应的离子方程式为:CH3COOH+HSO3-═SO2+H2O+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:MnO4- Na+ I- Mg2+ | |
| B. | 含有0.1mol/L Fe3+ 的溶液中:Na+ Ca2+ SCN- SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32- SO42- Na+ NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+ Cl- NO3- Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com