
| A. | 收集氯气用排饱和食盐水的方法 | |
| B. | 加压条件下有利于SO2和O2反应生成SO3 | |
| C. | 将NO2球浸泡在热水中颜色加深 | |
| D. | 加催化剂,使N2和H2在一定的条件下转化为NH3 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、氯气和水反应生成氯化氢和次氯酸是化学平衡,饱和食盐水中氯离子浓度大,减小氯气的溶解度,收集氯气用排饱和食盐水的方法,能用化学平衡移动原理解释,故A不符合;
B、二氧化硫和氧气反应生成三氧化硫是气体体积减小的反应,增大压强平衡正向进行,能用化学平衡移动原理解释的,故B不符合;
C、二氧化氮转化为四氧化二氮是放热反应,所以温度升高平衡移动,能用化学平衡移动原理解释的,故C不符合;
D、催化剂改变反应速率,不改变化学平衡,加催化剂,使N2和H2在一定的条件下转化为NH3,不能用化学平衡移动原理解释,故D符合;
故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.


科目:高中化学 来源: 题型:实验题
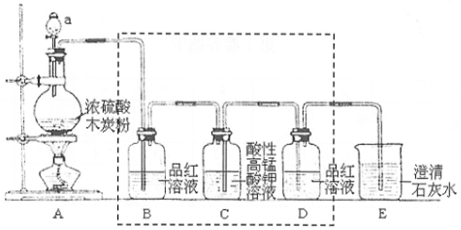
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| B. | 将1mol/L的NaCl溶液保存在容量瓶中 | |
| C. | 凡是给玻璃仪器加热,都要垫石棉网,以防仪器炸裂 | |
| D. | 用pH试纸检验某溶液的酸碱性时,一定要先用蒸馏水湿润 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
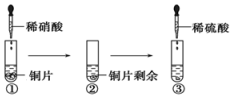
| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ②中溶液存在:c(Cu2+)+c(H+)=c(NO3-)+c(OH-) | |
| C. | 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应 | |
| D. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
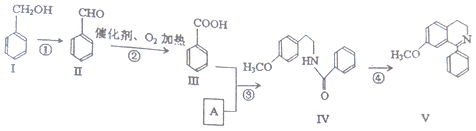
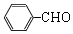 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2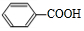 .
. +
+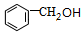 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$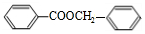 +H2O.
+H2O.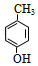 .
.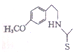 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCH4含有5NA个电子 | |
| B. | 标准状况下,22.4L氦气含有2NA个原子 | |
| C. | 常温常压下,22.4L CO2和SO2混合气体含有2NA个氧原子 | |
| D. | 46gNO2和N2O4的混合气体含氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com