
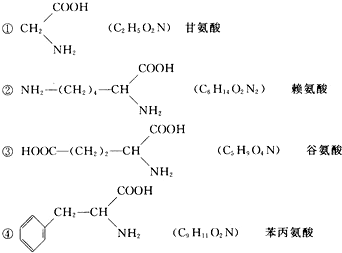
分析 有一个十肽A,其分子式为C 65H 86O 17N 12,如都含有1个氨基,则含有的N原子数为10,则分子中含有12个N,说明一定含有2个赖氨酸,如只含有1个羧基,则10分子氨基酸脱去9分子水,含有的O原子数应为2×10-9=11,而分子中含有17个O原子,则说明含有3个谷氨酸,结合分子式中C、H个数确定甘氨酸和苯丙氨酸,以此解答该题.
解答 解:(1)求谷氨酸和赖氨酸个数用构造法.四种氨基酸,三种类型,每种类型各取一种分别缩聚(构造模型)得: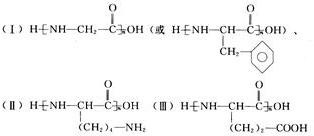
分析三种模型的不同,可以得出如下结论:
a.肽分子中若没有谷氨酸,则O原子数比肽数的2倍多1;肽分子中若没有赖氨酸,则N原子数等于肽数.
b.肽分子中每增加一个谷氨酸就增加两个O原子,每增加一个赖氨酸就增加一个N原子.
那么,肽分子中的赖氨酸数目为:12-10=2,肽分子中的谷氨酸数目为$\frac{17-(10+1)}{2}$=3,
(2)求甘氨酸和苯丙氨酸个数用残基法:
C 65H 86O 17N 12+9H 2O-2C 6H 14O 2N 2-3C 5H 9O 4N=C 38H 49O 10N 5
C 38H 49O 10N 5是5个氨基酸的总式,
可知1个甘氨酸,4个苯丙氨酸符合题意,
答:四种氨基酸按题给顺序分别是1、2、3、4个.
点评 本题考查有机物结构和组成的计算和推断,侧重于学生的分析、计算能力的考查,注意把握有机物的分子式与组成元素的特点,首先要求考生识记氨基酸脱水缩合的概念,掌握氨基酸脱水缩合过程,能根据N原子数目计算出氨基酸数目;其次要求考生能根据氧原子数目计算出谷氨酸的数目,再进而根据C和H原子数目计算出甘氨酸和丙氨酸的数目,难度中等,


科目:高中化学 来源: 题型:解答题
 .
.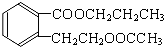 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$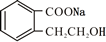 +CH3COONa+CH3CH2CH2OH.
+CH3COONa+CH3CH2CH2OH.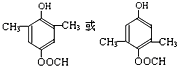 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
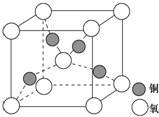 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
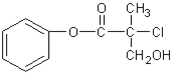
| A. | 1mol A最多能与4mol H2发生加成反应 | |
| B. | 有机物A可以在一定条件下与HBr发生反应 | |
| C. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| D. | 1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
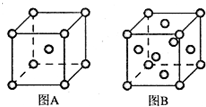
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
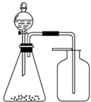
| A. | 浓氨水与固体CaO制氨气 | B. | 盐酸与CaCO3固体制CO2 | ||
| C. | 稀硝酸与铜片制NO | D. | 饱和食盐水与电石制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量前先调节托盘天平的零点 | |
| B. | 称量时左盘放被称量物,右盘放砝码 | |
| C. | 潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 用托盘天平可以准确称量至0.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
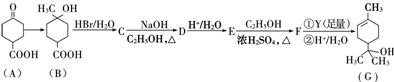
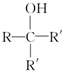 ,请回答下列问题:
,请回答下列问题: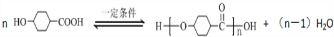 .
. .
.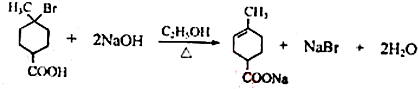 .
.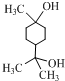 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
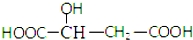 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| D. | 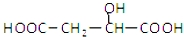 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com