

| A. | 室温下,HA-的电离常数Ka2=1.0×10-7 | |
| B. | 室温下,0.1mol/L的NaHA溶液显酸性 | |
| C. | 室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液pH=1.8 | |
| D. | 0.1mol/L的Na2A溶液中c(OH-)=c(H+)+c(HA-)+2c(H2A) |
分析 根据图知,pH为0-4时,实线表示H2A、虚线表示HA-,pH=4-5虚线表示HA-,pH>5时,下降的虚线表示HA-,上升的虚线表示A2-,
A.室温下,HA-的电离常数Ka2=$\frac{c({A}^{2-}).c({H}^{+})}{c(H{A}^{-})}$;
B.根据图知,pH=4-5时,溶液中阴离子主要是HA-;
C.室温下,0.2mol/L的H2A与0.1mol/L的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaHA、H2A;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:根据图知,pH为0-4时,实线表示H2A、虚线表示HA-,pH=4-5虚线表示HA-,pH>5时,下降的虚线表示HA-,上升的虚线表示A2-,
A.室温下,pH=7时,c(A2-)=c(HA-),HA-的电离常数Ka2=$\frac{c({A}^{2-}).c({H}^{+})}{c(H{A}^{-})}$=1.0×10-7,故A正确;
B.根据图知,pH=4-5时,溶液中阴离子主要是HA-,溶液pH接近4-5,溶液呈酸性,故B正确;
C.室温下,0.2mol/L的 H2A与0.1mol/L的NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NaHA、H2A,但是H2A部分电离,所以溶液中两种阴离子浓度不等,则溶液的pH不等于1.8,故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(HA-)+2c(A2-)+c(OH-),根据物料守恒得c(Na+)=2[c(HA-)+c(A2-)+c(H2A)],所以得c(OH-)=c(H+)+c(HA-)+2c(H2A),故D正确;
故选C.
点评 本题以弱电解质的电离为载体考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中微粒浓度变化与溶液pH的关系是解本题关键,难点是A选项中电离平衡常数的计算,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | IBr可能是一种有色物质 | |
| B. | 在许多反应中IBr是强氧化剂 | |
| C. | 在IBr与水的反应中,IBr既是氧化剂又是还原剂 | |
| D. | 与NaOH溶液反应有NaIO生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图: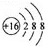 | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O2- | |
| C. | NH4Cl的电子式: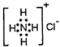 | |
| D. | 碘的外围电子排布:4s24p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al粉和Fe3O4粉末混合 | B. | V2O5粉末和Al粉混合 | ||
| C. | Al粉和MgO粉末混合 | D. | C粉和CuO粉末混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr比HCl的热稳定性差,说明HBr的分子间作用力比HCl弱 | |
| B. | 二氧化硅融化和干冰气化,所克服的作用力不相同 | |
| C. | I2、HCl、NH3均属于共价化合物 | |
| D. | 若熔融状态的晶体能导电,则该晶体中必定存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Th元素的质量数是231 | B. | ${\;}_{92}^{233}$U的中子数为92 | ||
| C. | 232Th的摩尔质量为232 | D. | 230Th和232Th的化学性质相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com