
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
A.①②③B.②③④C.①③⑤D.②④⑤
【答案】C
【解析】
①Al2O3为两性氧化物,与NaOH反应生成NaAlO2,向该溶液中通入CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故①能够实现;
②S与O2反应生成SO2,不能直接生成SO3,故②不能实现;
③利用NaHCO3溶解度小于Na2CO3,NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,受热易分解成Na2CO3,故③能够实现;
④FeCl3属于强酸弱碱盐,Fe3+发生水解,加热FeCl3溶液得到无水FeCl3,需要在氯化氢的氛围中,故④不能实现;
⑤Mg(OH)2比Ca(OH)2更难溶,加入石灰乳,发生MgCl2+Ca(OH)2=Mg(OH)2+CaCl2,Mg(OH)2受热分解成MgO,故⑤能够实现;
综上所述,能够实现的是①③⑤,故选项C正确;
答案:C。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂有苯酚和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中__加入甲醛,且反应釜应装有__装置;
(2)玻璃纤维由玻璃拉丝得到.普通玻璃是由石英砂、__和石灰石(或长石)高温熔融而成,主要反应的化学方程式为__;
(3)玻璃钢中玻璃纤维的作用是__;玻璃钢具有__等优异性能(写出亮点即可);
(4)下列处理废旧热固性酚醛塑料的做法合理的是__;
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)

a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。其结构简式如图所示。
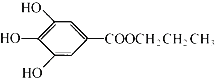
已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
回答下列问题:
(1)从分子结构或性质上看,PG具有抗氧化作用的主要原因是:______(文字简述)
(2)1mol没食子酸最多可以与含________mol碳酸钠的溶液发生反应。
(3)写出PG在NaOH溶液中水解的化学方程式:_______________________。
(4)没食子酸有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:____。
a.含有苯环,且苯环上的一溴代物只有一种;
b.既能发生银镜反应,又能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g))![]() 2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1molSO2(g)被氧化为1molSO3(g)的ΔH=-akJ/mol(a﹥0)。回答下列问题:
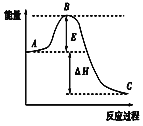
(1)图中A表示:__,E的大小对该反应的反应热ΔH__(填“是”或“否”)有影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点__(填“升高”或“降低”),理由是__。
(2)图中ΔH=__kJ/mol。
(3)在一定温度下,将2molSO2和1molO2放在一密闭容器中,在催化剂作用下充分反应。测得反应放出的热量__(填“等于”、“大于”或“小于”)2akJ。
(4)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
①__;②4VO2+O2=2V2O5
(5)已知固态单质硫的燃烧热为bkJ/mol,计算由S(s)生成3molSO3(g)的ΔH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药﹣羟苯水杨胺,其合成路线如图。回答下列问题:
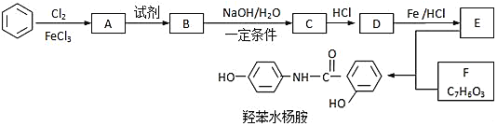
已知:![]()
(1)羟苯水杨胺的化学式为___。1mol羟苯水杨胺最多可以和___molNaOH反应。
(2)D中官能团的名称___。
(3)A→B反应所加的试剂是___。
(4)F存在多种同分异构体。
F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,且核磁共振氢谱显示4组峰,峰面积之比为1:2:2:1的同分异构体的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

①此反应的化学方程式中a :b=__________
②t1到t2时刻,以M的浓度变化表示的平均反应速率为:_________________
③下列叙述中能说明上述反应达到平衡状态的是______________
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(2)如图是某锌锰干电池的基本构造图。
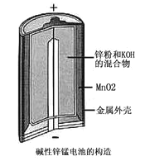
①该干电池的总反应式为2MnO2+Zn+2H2O=2MnO(OH)+ Zn(OH)2,该电池的负极是___________,工作时正极的电极反应式是______________________________。
②关于该电池的使用和性能,下列说法正确的是____________
A.该电池属于蓄电池
B.电池工作时OH-向负极移动
C.该电池的电解质溶液是H2SO4溶液
D.该电池用完后可随意丢弃,不需要回收处理
(3)另一种常用的电池锂电池由于比容量(单位质量电极材料所能转换的电量)特别大而广泛用于心脏起搏器,它的负极材料用金属锂制成,电解质溶液需用非水溶液配制,请用化学方程式表示不能用水溶液的原因_______________________________。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一氢氧燃料电池,以电极a为正极,电极b为负极,采用氢氧化钠溶液为电解液,则氧气应通入_________极(填序号),电解质溶液的pH将____________(填“变大”,“变小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com