
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) 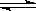 xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
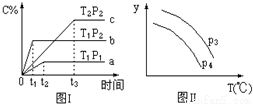
A.P3<P4,y轴表示B的转化率
B.P3<P4,y轴表示B的体积分数
C.P3>P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源:2016-2017学年黑龙江佳木斯一中高一上第一次月考化学卷(解析版) 题型:选择题
下列分离或提纯物质的方法不正确的
A.用蒸馏法将海水淡化
B.用酒精萃取溴水中的溴
C.用升华法除去NaCl中含有的少量I2
D.用结晶法除去NaCl中混有的KNO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学卷(解析版) 题型:选择题
在标准状况下,将A气体(不与水反应,摩尔质量是(Mg·mol-1)VL溶于0.5L水中,所得溶液的密度为ag·cm-3,则此溶液的物质的量浓度(mol·L-1)为
A.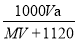 B.
B.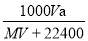 C.
C. D.
D.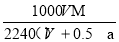
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:填空题
Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)  CH3O
CH3O CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3(g) + H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。

(1)该条件下反应平衡常数表达式K=______________;在t1 ℃时,反应的平衡常数为____________,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=_____________________。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为:c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4mol·L-1,此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”),反应向__________反应方向进行(填“正”或“逆”).。
Ⅱ.已 知可逆反应:M(g)+N(g)
知可逆反应:M(g)+N(g)  P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________。
(2)若反应温度升高,M的转化率__________(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:选择题
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
 下列说法正确的是( )
下列说法正确的是( )
A.反应在t1 min内的平 均速率为:v(H2)=
均速率为:v(H2)=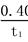 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)  C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均摩尔质量
A.②③⑤ B.①②③ C.②③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上10月月考化学卷(解析版) 题型:选择题
已知在1.01×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
B.H2O(g)=H2(g)+ O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
C.H2(g)+ O2(g)=H2O(g) ΔH=-484kJ·mol-1
O2(g)=H2O(g) ΔH=-484kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上月考一化学试卷(解析版) 题型:填空题
(1)常温常压下,依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ。则表示甲醇燃烧热 的热化学方程式为______________________。
的热化学方程式为______________________。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量__________________。
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C—H | 414 | C—F | 489 | H—F | 565 | F—F | 158 |
H-H | 436 | H-N | 391 |
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol -1 计算N≡N的键能。
-1 计算N≡N的键能。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256kJ的热量(25℃、101 kPa下测得的热量)。
①该反应的热化学方程式为 。
②又已知H2O(l) =H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:填空题
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti原子电子占据的最高能层符号________,基态Ti2+的价电子的电子排布式 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2?2NH3实现储氢和输氢.下列说法正确的是_________(填序号);
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与C1O4-、PH4+、CH4、BH4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.电负性C<N<O , 第一电离能C< O < N
(3)Se与O同族,则 SeO2分子的空间构型为
(4)富勒 烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
烯(C60)的结构如图甲,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 个.
(5)图乙为一个金属铜的晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol﹣1(用含a、ρ的代数式表示).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com