
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:推断题

 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.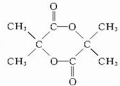 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
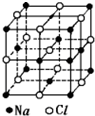 已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg.mol-1,NaCl晶体的密度为ρg.cm-3,图大正方体为NaCl晶体的最小重复单元(晶胞),其中顶点离子为8个晶胞所共有,晶胞中Na+与最邻近的Cl-的核间距离为a cm,则阿伏加德罗常数的值可表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F<Mg<K | B. | 碱性:Al(OH)3<Mg(OH)2<KOH | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ①②③④ | C. | ③①④② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加入稀释的过程中c(OH-)不断增大 | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8mol•L-1,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3 119.6 kJ•mol-1 | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1 559.8 kJ•mol-1 | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1 559.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
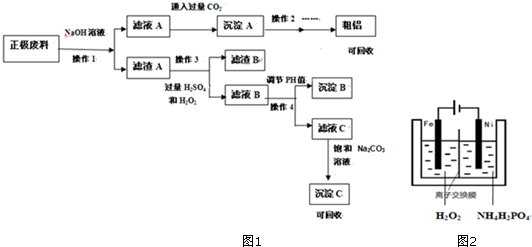
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com