
 ;
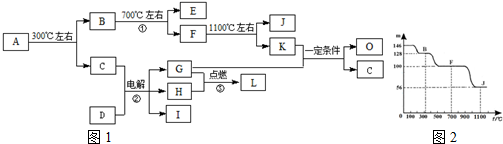
;分析 化合物A是尿路结石的主要成分,可用X•nH2O表示,在300℃下分解得到B与C,B继续加热分解得到的E被人体吸入,与血红蛋白结合而使人中毒,则E为CO,K的大量排放是造成地球温室效应的主要原因,则K为CO2,故C为H2O,D中的阳离子与C(水)分子有相同的电子数,D晶体中阴、阳离子个数比是1:1,电解D的溶液得到三种物质G、H、I,应是电解NaCl溶液,则D为NaCl,G与H在点燃条件下反应生成L,则G、H分别为氢气、氯气中的一种,L为HCl,I为NaOH;K与G反应得到O与C(水),故G为H2、H为Cl2,(4)中若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明,则O为CH3OH,若O是K与G按1:3的比例反应而得,则2CO2+6H2→C2H4+4H2O,所以可以得到有机物质是乙烯.
A中的阳离子与D中的阴离子的电子层结构相同,则A中阳离子为Ca2+,故X中含有Ca、C、O元素,X为CaC2O4,图上数据100到87.7为失去结晶水的过程,则$\frac{18n}{128+18n}$=1-87.7%,解得n=1,可以确定A为CaC2O4•H2O,则B为CaC2O4,A的相对分子质量为146,F的相对分子质量为146×68.5%=100,故F为CaCO3,J的相对分子质量为146×38.4%=56,故J为CaO,据此解答.
解答 解:化合物A是尿路结石的主要成分,可用X•nH2O表示,在300℃下分解得到B与C,B继续加热分解得到的E被人体吸入,与血红蛋白结合而使人中毒,则E为CO,K的大量排放是造成地球温室效应的主要原因,则K为CO2,故C为H2O,D中的阳离子与C(水)分子有相同的电子数,D晶体中阴、阳离子个数比是1:1,电解D的溶液得到三种物质G、H、I,应是电解NaCl溶液,则D为NaCl,G与H在点燃条件下反应生成L,则G、H分别为氢气、氯气中的一种,L为HCl,I为NaOH;K与G反应得到O与C(水),故G为H2、H为Cl2,(4)中若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明,则O为CH3OH,若O是K与G按1:3的比例反应而得,则2CO2+6H2→C2H4+4H2O,所以可以得到有机物质是乙烯.
A中的阳离子与D中的阴离子的电子层结构相同,则A中阳离子为Ca2+,故X中含有Ca、C、O元素,元素化合价分析可知X含有的三种元素的原子个数之比为1:2:4,故X为CaC2O4,图上数据100到87.7为失去结晶水的过程,则$\frac{18n}{128+18n}$=1-87.7%,解得n=1,可以确定A为CaC2O4•H2O,则B为CaC2O4,A的相对分子质量为146,F的相对分子质量为146×68.5%=100,故F为CaCO3,J的相对分子质量为146×38.4%=56,故J为CaO,据此解答.
(1)由上述分析可知,A的化学式为CaC2O4•H2O,D为NaCl,其中阴离子为Cl-,Cl-离子结构示意图为 ,
,
故答案为:CaC2O4•H2O; ;
;
(2)反应①的化学方程式为:CaC2O4$\frac{\underline{\;高温\;}}{\;}$CaCO3+CO↑,
故答案为:CaC2O4$\frac{\underline{\;高温\;}}{\;}$CaCO3+CO↑;
(3)①若O是一种易挥发的液态燃料,有毒,误饮5~10mL会导致双目失明,则O为CH3OH,故答案为:CH4O;
②若O是K与G按1:3的比例反应而得,则2CO2+6H2→C2H4+4H2O,所以可以得到有机物质是乙烯,故答案为:B.
点评 本题以框图形式考查无机物推断,基本属于猜测验证型推断,根据A的化学式确定C为水以及E、K的性质等是推断突破口,注意充分利用题目信息,需要学生熟练掌握元素化合物性质,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2与H2S04 | B. | FeBr2与Cl2 | C. | HCI与Na2CO3 | D. | NaHC03与Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| B. | 常温常压下,4.6 g NO2气体含有0.1NA个分子 | |
| C. | 常温下,1L0.50mol•L-1NH4Cl溶液与2L0.25 mol•L-1NH4Cl溶液含NH4+物质的量不同 | |
| D. | l mol•L-1的NaClO溶液中ClO-和HClO共NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与甲醚(CH3-O-CH3)互为同分异构体 | |
| B. | 乙醇易燃烧,污染小 | |
| C. | 乙醇只能在实验室内作燃料 | |
| D. | 粮食作物是制乙醇的重要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | Ba(OH)2溶液 | C. | BaCl2溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.
 +4NaOH$\stackrel{△}{→}$2CH3COONa+
+4NaOH$\stackrel{△}{→}$2CH3COONa+ +4H2O.
+4H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com