
| A. | 萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大 | |
| B. | 检验溶液中是否有SO42-时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失 | |
| C. | 以酚酞为指示剂向盐酸中滴加氢氧化钠溶液时,滴定终点时溶液由粉红色恰好变为无色 | |
| D. | 酸式滴定管、碱式滴定管、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
分析 A.萃取剂与原溶剂不能互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂与水的密度相对大小无关;
B.能和BaCl2溶液的有银离子、硫酸根离子和亚硫酸根离子,且加入稀硝酸时沉淀都不溶解;
C.酚酞试液在酸性溶液中呈无色、在碱性溶液中呈红色;
D.移液管不需要检查是否漏水.
解答 解:A.萃取剂与原溶剂不能互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂与水的密度相对大小无关,所以萃取操作时,应选择有机萃取剂,萃取剂的密度不一定比水大,如苯的密度小于水,故A正确;
B.能和BaCl2溶液的有银离子、硫酸根离子和亚硫酸根离子,且加入稀硝酸时沉淀都不溶解,应该先加稀盐酸后加氯化钡溶液检验硫酸根离子,故B错误;
C.酚酞试液在酸性溶液中呈无色、在碱性溶液中呈红色,滴定终点时溶液由无色变为红色,故C错误;
D.移液管没有活塞或塞子,所以不需要检查是否漏水,酸式滴定管,碱式滴定管在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及萃取剂的选取、离子检验、酸碱中和滴定、仪器的选取和使用,明确实验原理、仪器的用途、基本实验操作是解本题关键,侧重考查学生分析判断及基本操作能力,易错选项是B,注意硝酸的强氧化性.


科目:高中化学 来源: 题型:选择题
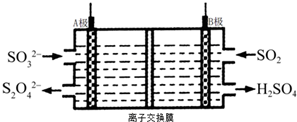
| A. | A电极接电源的正极 | |
| B. | A极区溶液的碱性逐渐增强 | |
| C. | 本装置中使用的是阴离子交换膜 | |
| D. | B极的电极反应式为SO2+2e-+2H2O═SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固体氯化氨中存在离子数小于2NA | |
| B. | 标准状况下,22.4L己烷中共价键的数目为19NA | |
| C. | 标况下的NO2气体22.4L,其中含有的氮原子数为NA | |
| D. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应生成氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 将溴水加入苯中,溴水褪色是因为发生了加成反应 | |
| C. | 油脂和蛋白质都可以发生水解反应 | |
| D. | 乙醇、苯、乙酸均可发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式:Ag+Cl--e-═AgCl | |
| B. | AgCl是氧化产物 | |
| C. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com