
【题目】在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( ) 
A.图中a点的值为0.05
B.该反应的平衡常数K=0.03
C.平衡时A2的转化率为62.5%
D.温度升高,平衡常数K值增大
【答案】C
【解析】解:A、当AB的浓度改变0.5 molL﹣1 , 由方程式A2(g)+B2(g)2AB(g)知,A2的浓度改变为0.25molL﹣1 , 所以a=(0.4﹣0.25)molL﹣1=0.15molL﹣1 , 即图中a点的值为0.15,故A错误;B、当AB的浓度改变0.5 molL﹣1 , 由方程式知,B2的浓度改变为0.25molL﹣1 , 所以平衡时B2的浓度为=(0.3﹣0.25)molL﹣1=0.05molL﹣1 , K= ![]() =
= ![]() =
= ![]() ,故B错误;
,故B错误;
C.当AB的浓度改变0.5 molL﹣1 , 由方程式知,A2的浓度改变为0.25molL﹣1 , 已知A2的初始量为0.4molL﹣1 , 所以平衡时A2的转化率为: ![]() ×100%=62.5%,故C正确;
×100%=62.5%,故C正确;
D.反应A2(g)+B2(g)2AB(g)的△H<0,为放热反应,所以温度升高,平衡逆移,平衡常数K值减小,故D错误;
故选C.
A.根据AB的浓度变化结合反应方程式计算A2的浓度变化,从而得出a值;
B.根据化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比进行计算;
C.根据转化的A2的量和A2的初始量求算;
D.根据放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】某白色粉末可能含有CaCO3、BaCl2、NaNO3、K2SO4、CuSO4中的一种或几种。现进行如下操作:
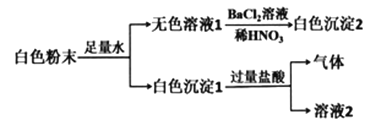
根据以上实验现象,下列说法中不正确的是
A. 白色粉末中一定不含CuSO4
B. 白色粉末中可能含有NaNO3、BaCl2
C. 该白色粉末中一定含有CaCO3、K2SO4
D. 无色溶液1发生焰色反应时,可透过蓝色钴玻片观察到火焰呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( ) ①放热反应在常温下均能自发进行;
②电解过程中,电能转化为化学能而“储存”在反应物中;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤化学平衡常数的表达式与化学反应方程式的书写无关.
A.①②③④
B.①③④⑤
C.②③⑤
D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.
①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验.
①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 . 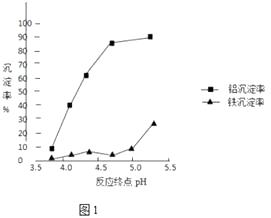
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 .
已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
(5)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中将盛有甲烷与氯气的混合气体的量筒倒立在盛有饱和食盐水的水槽中,光照使其发生反应,下列说法错误的是( )
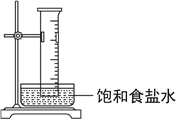
A. 通过量筒内壁上出现的油状液滴可以说明生成四种有机产物
B. 氯化氢极易溶于水,导致量筒中液面上升
C. 饱和食盐水能够抑制氯气的溶解
D. 量筒中气体颜色逐渐变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 120克NaHSO4固体含有离子数目为3NA
B. 总质量为1g的O2与N2混合气体含有的电子数为0.5NA
C. Na2O2与CO2反应时,每产生1 mol O2转移电子数为NA
D. 向含有FeI2的溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
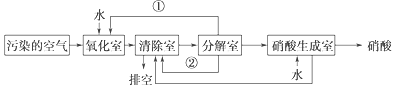
各室中发生的反应如下:
氧化室:NO2+SO2+H2O==H2SO4+NO
清除室:NO+NO2==N2O3、N2O3+2H2SO4==2NOHSO4(固体)+H2O
分解室:4NOHSO4(固体)+O2+2H2O==4H2SO4+4NO2
(1)物质①和②分别为(填化学式)________、__________。
(2)写出SO2、O2与H2O反应生成H2SO4的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com