
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.标准状况下,22.4LH2O含有的分子数为NA
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b molNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl﹣、ClO﹣、ClO3﹣ , 且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量( )
A.![]()
B.![]() mol
mol
C.( ![]() ﹣
﹣ ![]() )mol
)mol
D.![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的氢离子浓度均减小
D.产生气泡的速度甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为( )
A.84%
B.60%
C.91%
D.42%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计如图实验装置(夹持装置略去)制备氯气并探究氯气的相关性质.D装置为分液漏斗形状,低进高出. 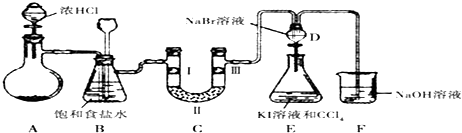
(1)若A装置中固体药品为MnO2 , 写出其离子反应方程式;若A装置中固体药品为KC1O3 , 则反应中每生成1mol Cl2时转移电子数目为 .
(2)装置B的作用是和 , 若C处发生了堵塞,则B中的现象 .
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是( )
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属的叙述中,正确的是 ( )
A. 灼烧氯化钾时,火焰没有特殊颜色B. 硝酸铷是离子化合物,易溶于水
C. 在钠、钾、铷三种单质中,铷的熔点最高D. 氢氧化铷是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com