
| A. | N2的结构式 N≡N | B. | 氯化铵的电子式 | C. | S2-的结构示意图 | D. | 甲烷的比例模型  |
分析 A.氮气分子中含有氮氮三键,用短线代替共用电子对即为结构式;
B.氯化铵为离子化合物,阴阳离子都需要标出所带电荷及共用电子对;
C.硫离子的核电荷数为16,核外电子总数为18,最外层达到8电子稳定结构;
D.该模型为球棍模型,比例模型需要体现出各原子的相对体积大小.
解答 解:A.氮气的电子式为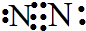 ,则氮气的结构简式为N≡N,故A正确;
,则氮气的结构简式为N≡N,故A正确;
B.氯化铵属于离子化合物,其化学式中存在氯离子和铵根离子,氯化铵的电子式为: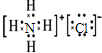 ,故B正确;
,故B正确;
C.硫离子的核外电子总数为18,核电荷数为16,其电子式为: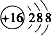 ,故C正确;
,故C正确;
D.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷的比例模型为: ,故D错误;
,故D错误;
故选D.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及比例模型、离子结构示意图、电子式、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{H_{2}SO_{4}(浓)}$Cu(NO3)2 | B. | Cu$→_{△}^{空气}$CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | D. | Cu$\stackrel{HNO_{3}(浓)}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 、②⑤
、②⑤ 、③⑦
、③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,18g14CH4所含质子数目为10NA | |
| C. | 标准状况下的22.4L氯气与足量铁反应生成三氯化铁,转移的电子数目为3NA. | |
| D. | 0.1L 1mol/L的NH4C1溶液中存在的NH4+数目为0.1NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 是将化学能转化成电能的装置 | |
| B. | Cu上有气体放出 | |
| C. | Mg是负极,电极反应是Mg-2e-═Mg2+ | |
| D. | 导线中有电流通过,电流方向是由Mg到Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
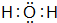 、
、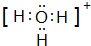 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物在社会生产、生活中起着非常重要的作用.
有机物在社会生产、生活中起着非常重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Cu2+,OH-,HCO3- | B. | Mg2+,NH4+,Br-,SO42- | ||
| C. | Ca2+,Fe3+,Cl-,CO32- | D. | Fe2+,H+,ClO-,SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com