
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。

下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
【答案】C
【解析】
由示意图可知,该反应反应物总能量小于生成物总能量,为吸热反应,△H>0。
A项、该反应为吸热反应,N2(g)+O2(g)=2NO(g) △H=+180kJ/mol,故A错误;
B项、正反应为吸热反应,逆反应应该为放热反应,则NO(g)=1/2N2(g)+1/2O2(g) △H=-90![]() ,故B错误;
,故B错误;
C项、反应热等于反应物键能之和减去生成物的键能之和,△H=[(946kJ/mol+498kJ/mol))- 2×E(N—O)]= +180kJ/mol,E(N—O)=632 kJ/mol,则断开1mol NO(g)中化学键需要吸收632kJ能量,故C正确;
D项、反应热等于反应物键能之和减去生成物的键能之和,△H=[(946kJ/mol+498kJ/mol))- 2×E(N—O)]= +180kJ/mol,E(N—O)=632 kJ/mol,则形成1 mol NO(g)中化学键可释放632kJ能量,故D错误。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ/mol和-297kJ/mol,则CH4和SO2反应的热化学方程式为_________________________________________。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
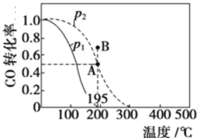
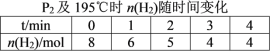
①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(CH3OH)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。
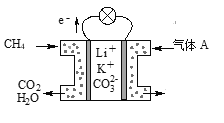
①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。
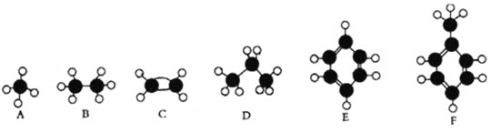
(1)常温下含碳量最高的是________(填对应字母);
(2)一卤代物种类最多的是 ___________(填对应字母);
(3)A、B、D三种物质的关系为____________________________________
(4)F中一定在同一个平面的原子数目为_____________________
(5)写出C使溴水褪色的方程式 ___________
(6)写出E发生溴代反应的化学方程式______________________________;
(7)写出C的官能团的名称______________________
(8)F的二溴取代产物有_____________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为:2H2+O2=2H2O
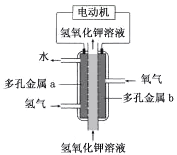
下列说法不正确的是
A. 多孔金属a作负极
B. 多孔金属b上,O2发生还原反应
C. 电池工作时,电解质溶液中OH- 移向a极
D. 正极的电极反应为:O2 +4e- +4H+ =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
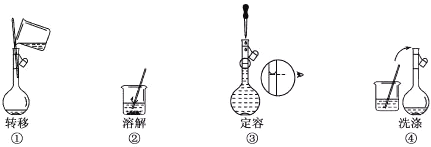
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。

下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com