
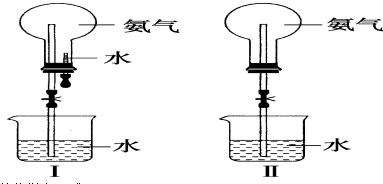
分析 (1)验室用熟石灰和氯化铵在加热条件下反应制备氨气;
(2)氨气易溶于水,密度比空气小,溶液具有碱性,易与酸反应;
(3)利用氨气极易溶于水,形成压强差而形成喷泉,
(4)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时会导致烧瓶内压强减小;
(5)氨气催化氧化生成NO和水.
解答 解:(1)实验室用熟石灰和氯化铵在加热条件下反应制备氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O;
(2)氨气极易溶于水,不能用排水法收集,密度比空气小,用向下排空气法收集,氨气为碱性气体,用碱石灰干燥,
故答案为:向下排空气;碱石灰;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;氨气极易溶解于水,致使烧瓶内气体压强迅速减小;
(4)加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时,因氨气极易溶于水而导致烧瓶内压强迅速减小而形成喷泉,
故答案为:打开夹子,用热毛巾将烧瓶捂热,氨气受热膨胀,赶出玻璃管内的空气,氨气与水接触,即形成喷泉;
(5)氨气催化氧化生成NO和水,反应的方程式为4NH4Cl+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH4Cl+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查学生对元素化合物知识的熟悉程度,为高频考点,要求学生综合题中信息,结合对物质性质的了解,注意相关知识的积累,把握形成喷泉的实验条件以及对应物质的性质,难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
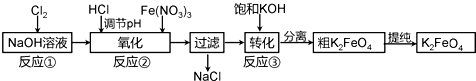
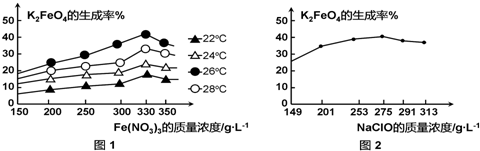
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
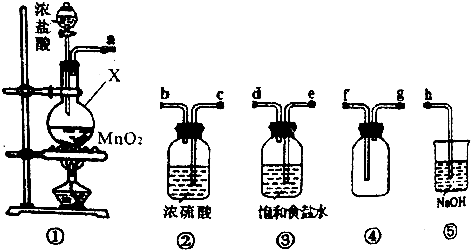
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | |
| R | |||
| W | |||
| J |
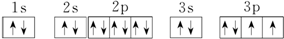 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0 g熔融的NaHSO4中含有离子总数为0.2NA | |
| B. | 电解精炼Cu时,导线中通过2NAe-时,阳极质量减少64 g | |
| C. | 标准状况下,11.2 LCHCl3中含有的共用电子对数目为2NA | |
| D. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
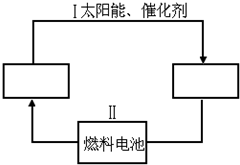 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8% | B. | 9% | C. | 10% | D. | 5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com