

分析 (1)化学式中元素化合价代数和为0计算;
(2)①根据H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐为强碱弱酸盐;
②根据化合物中总化合价为0计算出P元素的化合价,在碱性条件下,次磷酸盐可用于化学镀银和银离子反应生成磷酸根、银和水,结合电子守恒和原子守恒配平书写离子方程式;
(3)①根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,判断放电能力强弱,然后写出阳极的电极反应式;
②根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因;
③根据阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,氢氧根离子失电子发生氧化反应,阴极上是氢离子得到电子发生还原反应,写出阴极的电极反应式计算;
(4)根据Ksp[Ca3(PO4)2]=c3(Ca2+)×c2(PO43-)=2.0×10-29计算.
解答 解:(1)根据化合价代数和为0,则(n+2)+5n-2x=0,故x=3n+1,故答案为:3n+1;
(2)①H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2?H2PO2-+H+,根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐为强碱弱酸盐,NaH2PO2水溶液中阴离子水解溶液显碱性,
故答案为:H3PO2?H2PO2-+H+;碱性;
②根据化合物中总化合价为0计算出P元素的化合价,H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为+1价,在碱性条件下,次磷酸盐可用于化学镀银和银离子反应生成磷酸根、银和水,结合电子守恒和原子守恒配平书写离子方程式,磷元素化合价+1价变化为+5价,银离子化合价+1价变化为0价,碱性条件下反应得到离子方程式为:H2PO2-+4Ag++6 OH-═PO43-+4Ag↓+4 H2O,
故答案为:+1;1、4、6 OH-、1、4、4 H2O;
(3)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,
故答案为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;
③由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH--4e-=O2↑+2H2O,阴极电极反应是溶液中氢离子得到电子发生还原反应,2H++2e-=H2↑,电子守恒计算,4OH-~4e-~4H+~4H3PO2,得到1mol H3PO2的同时阴极室制得NaOH质量为40g/mol×1mol=40g,
故答案为:40;
(4)处理后的废水中c(PO43-)=4×10-7 mol•L-1,Ksp[Ca3(PO4)2]=c3(Ca2+)×c2(PO43-)=c3(Ca2+)×(4.0×10-7)2=2.0×10-29,c(Ca2+)=5×10-6mol•L-1,
故答案为:5×10-6.
点评 本题考查了盐的水解原理、弱电解质的电离、氧化还原反应等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 | |
| B. | 二氧化硫能使品红褪色,加热后不恢复到红色 | |
| C. | 二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性 | |
| D. | 二氧化硫属于碱性氧化物,可以用NaOH溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多糖和蛋白质都是高分子化合物 | |
| B. | 淀粉和纤维素分子式相同、结构不同,二者互为同分异构体 | |
| C. | 蛋白质和多糖在一定条件下都能发生水解反应 | |
| D. | 蛋白质具有酸碱两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | |
| B. | 1mol N2和3mol H2的总能量低于2mol NH3的总能量 | |
| C. | 达到化学反应限度时,生成2molNH3 | |
| D. | 平衡时各组分含量之比一定等于3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
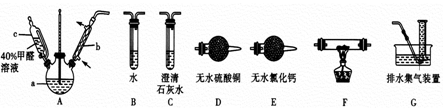

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
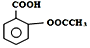 所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 该化合物的分子式为C9H10O4 | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 与乙酰水杨酸具有相同官能团,且苯环上只有两个取代基的芳香族同分异构体共有8种(不考虑立体异构) | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用小苏打溶液解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有的共价键数为4 NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4 NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5 mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ①②③④⑤ | C. | ①③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com