
【题目】50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
回答下列问题:

(1)烧杯间填满碎纸条的作用是_____________________,大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会 ________(填“偏大”、“偏小”、“无影响”)。
(3)实验时所用盐酸及NaOH溶液的密度均为1g·cm3,生成溶液的比热容为:c=4.18 kJ·kg-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试计算生成1mol水时的焓变:△H=________________。
【答案】 防止热量散失 偏小 偏大 △H=-16.72(t2-t1)kJ·mol-1
【解析】试题分析:本题考查中和热的测定,误差分析和数据处理。
(1)烧杯间填满碎纸条的作用是防止热量散失。大烧杯上如不盖硬纸板,将损失较多的热量,求得的中和热数值偏小。
(2)浓硫酸溶于水放热,若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会偏大。
(3)反应中生成n(H2O)=n(HCl)=0.5mol/L![]() 0.05L=0.025mol,反应中放出的热量Q=cmΔt=4.18 kJ·kg-1·℃-1
0.05L=0.025mol,反应中放出的热量Q=cmΔt=4.18 kJ·kg-1·℃-1![]() (1g/cm3
(1g/cm3![]() 50mL+1g/cm3
50mL+1g/cm3![]() 50mL)
50mL)![]() 10-3kg/g(t2-t1)℃=0.418(t2-t1)kJ,生成1molH2O时的焓变ΔH=-
10-3kg/g(t2-t1)℃=0.418(t2-t1)kJ,生成1molH2O时的焓变ΔH=-![]() =-16.72(t2-t1)kJ/mol。
=-16.72(t2-t1)kJ/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,下列对应关系不正确的是( )
A. 酸雨——二氧化硫 B. 温室效应——二氧化碳
C. 光化学烟雾——二氧化氮 D. 白色污染——二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其正极反应式为 _________________________________。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)_________________
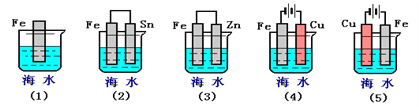
(Ⅲ)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
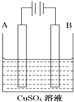
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是_______________________。
②镀层破损后,镀铜铁比镀锌铁更_______被腐蚀(填“容易”“不容易”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.NaCl 溶液在电流的作用下电离成 Na+和 Cl-
B.由非金属元素组成的化合物一定是共价化合物
C.离子化合物中可能含有非极性键或极性键
D.分子晶体中,分子间作用力越大,分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,有下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
2NH3(g) ΔH=-93.4 kJ·mol-1,有关该反应的叙述正确的是( )
A. 缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动
B. 将1 mol N2和3 mol H2充分反应达到平衡时,放出的热量等于93.4 kJ
C. 催化剂能缩短该反应达到平衡所需的时间,从而提高N2的转化率
D. 若混合气体中各成分的浓度不再变化,则该反应已达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是
选项 | A | B | C | D |
电解质溶液pH 变化 | HCl | AgNO3 | KOH | BaCl2 |
pH变化 | 减小 | 增大 | 增大 | 不变 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com