
电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:______________________。

科目:高中化学 来源: 题型:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
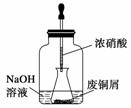
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式____________。
(2)上图装置中NaOH溶液的作用是_____________________。
(3)步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样( )
(3)干燥环境下金属不被腐蚀( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀( )
查看答案和解析>>
科目:高中化学 来源: 题型:
以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色 B.阴极逸出气体
C.阳极附近溶液呈蓝色 D.溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
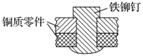
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置电解硫酸钾溶液制取氢气,氧气,硫酸和氢氧化钾。从开始通电时,收集B和C逸出的气体。1 min 后测得B口的气体体积为C口处的一半,下列说法不正确的是( )
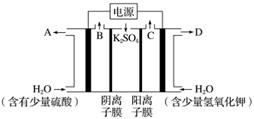
A.电源左侧为负极
B.电解槽左侧的电极反应方程式为2H2O-4e-===O2+4H+
C.D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大
D.在标准状况下,若1 min后从C口处收集到的气体比B口处收集到的气体多2.24 L,则有0.1NA个SO 通过阴离子膜
通过阴离子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)
ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_______________________________________。
(2)已知:CH3OH(g)+ O2(g)??CO2(g)+2H2(g)
O2(g)??CO2(g)+2H2(g)
ΔH1=-192.9 kJ·mol-1
H2(g)+ O2(g)??H2O(g)
O2(g)??H2O(g)
ΔH2=-120.9 kJ·mol-1
则甲醇与水蒸气催化重整反应的焓变ΔH3=__________________。
(3)苯乙烯是重要的基础有机原料。工业中用乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH===CH2)的反应方程式为
C6H5—CH2CH3(g)??C6H5—CH===CH2(g)+H2(g) ΔH1
已知:3C2H2(g)??C6H6(g) ΔH2
C6H6(g)+C2H4(g)??C6H5—CH2CH3(g) ΔH3
则反应3C2H2(g)+C2H4(g)??C6H5—CH===CH2(g)+H2(g)的ΔH=____________。
(4)氨的合成是最重要的化工生产之一。
工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)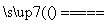 CO(g)+H2(g);
CO(g)+H2(g);
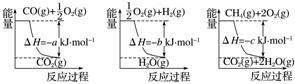
②用天然气跟水蒸气反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图所示,则方法②中反应的ΔH=____________。
(5)甲醇是一种用途广泛的化工原料。
工业上常用下列两种反应制备甲醇:
①CO(g)+2H2(g)??CH3OH(g)
ΔH1=-90.1 kJ·mol-1
②CO2(g)+3H2(g)??CH3OH(g)+H2O(l) ΔH2
已知:CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
则ΔH2=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com