
| A. | 蓝矾 玻璃 无色的刚玉 | B. | 汽油 液氯 醋酸 | ||
| C. | 石蜡 纯盐酸 王水 | D. | 干冰 铝热剂 铁触媒 |
分析 A、蓝帆是五水硫酸铜晶体,属于纯净物;
B、汽油含有多种烃,属于混合物;液氯 醋酸都是化合物;
C、纯盐酸含有HCl和H2O,王水含有HCl、HNO3、H2O;
D、干冰是固态CO2,属于纯净物.
解答 解:A、蓝帆是五水硫酸铜晶体,属于纯净物;玻璃含有多种成分,属于混合物,故A错误;
B、汽油含有多种烃,属于混合物;液氯 醋酸都是化合物,属于纯净物,故B正确;
C、纯盐酸含有HCl和H2O,王水含有HCl、HNO3、H2O,都属于混合物,故C错误;
D、干冰是固态CO2,属于纯净物;铝热剂 铁触媒含有多种成分,都是混合物,故D错误;
故选B.
点评 本题考查混合物与纯净物的区别,难度不大,注意混合物的多种成分.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法,不正确的是( )
的说法,不正确的是( )| A. | 既可催化加氢,又能使酸性KMnO4溶液褪色 | |
| B. | 可与浓溴水发取代生反应,但不能发生消去反应 | |
| C. | 1mol该化合物最多可与10molNaOH反应 | |
| D. | 可与FeCl3溶液发生显色反应,不与NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | FeSO4 | C. | KNO3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 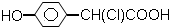 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com