
分析 (1)将镁条放入FeCl3溶液中有大量气泡,说明镁与氢离子反应生成氢气,FeCl3溶液发生水解显酸性,根据平衡移动分析解答;
(2)依据2Fe3++Cu=2Fe2++Cu2+,得出离子氧化性:Fe3+>Cu2+,结合Cu2+的氧化性大于H+判断,根据氧化性H+大于镁离子书写发生反应的离子方程式;
(3)根据Fe3+与KSCN溶液变血红色检验判断.
解答 解:(1)因为FeCl3溶液发生水解显酸性,即Fe3++3H2O?2Fe(OH)3+3H+,所以将镁条放入FeCl3溶液中,镁与水解生成的氢离子反应生成氢气,则有大量气泡,正好促进了三价铁离子的水解,先是生成红褐色的Fe(OH)3溶液,反应继续一段时间后,一是生成氢氧化铁量多,二是溶液中的氯化镁也增多,离子浓度增大,使红褐色的Fe(OH)3溶液聚沉生成红褐色Fe(OH)3沉淀;故答案为:镁与水解生成的氢离子反应生成氢气,促进了三价铁离子的水解,生成红褐色的Fe(OH)3溶液;一是生成氢氧化铁量多,二是溶液中的氯化镁也增多,离子浓度增大,使红褐色的Fe(OH)3溶液聚沉生成红褐色Fe(OH)3沉淀;
(2)因为2Fe3++Cu=2Fe2++Cu2+,所以离子氧化性:Fe3+>Cu2+,又氧化性Cu2+>H+>Mg2+,则氧化性Fe3+>H+>Mg2+,可能发生反应的离子方程式为2Fe3++Mg=2Fe2++Mg2+,故答案为:>;2Fe3++Mg=2Fe2++Mg2+;
(3)因为Fe3+与KSCN溶液变血红色,所以验证以上反应的存在的实验操作和结论为取反应后的溶液少量于试管中,滴加KSCN溶液,如果不变血红色,说明反应存在,反之则没有存在,故答案为:取反应后的溶液少量于试管中,滴加KSCN溶液,如果不变血红色,说明反应存在,反之则没有存在.
点评 本题主要考查了实验中一些特殊现象的探究分析,难度不大,注意物质基本性质的把握.


科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
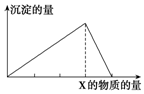 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.
(1)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为NO2+NO3--e-═N2O5.若生成1molY,则需要消耗标准状况下氧气的体积为5.6L.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
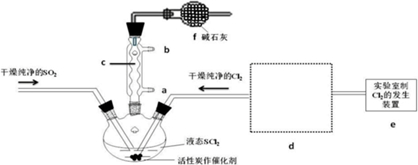
| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 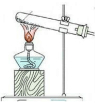 |  |  |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
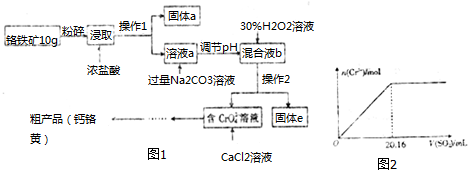
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com