
����Ŀ��ij�о���ѧϰС����ʵ������ģ��ʯ�͵Ĵ��ѻ�,װ����ͼ:ʵ������пɹ۲쵽��ƿ���й���ʯ�����ۻ�,�Թ�����������Һ������,�Թ��������Ը��������Һ��ɫ,ʵ������Թ�����Һ����ζ,�������͵���ζ��
��1����װ���������ӵ�˳��Ӧ��ѭ��ԭ��Ϊ_________________,����ҩƷ֮ǰ�IJ���Ϊ____________________________,�����ܵ�������_____________________________��
��2���Թ���������Һ������˵����_______________________��
��3���Թ�������Һ��ɫ˵����____________________________��
��4���ܷ����Թ����е�Һ����ȡ��ˮ�е���,������__________________________��
��5��д����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽ____________________________��
��6��ʯ���ѻ�����Ҫ������_______________________________________________��
���𰸡� ��������,�������� ����װ�õ������� �������������� �ѻ�������5��̼ԭ�������ϵ��� �ѻ�������̼ԭ����С��5��ϩ�� �������ѻ���������ϩ��,�����巢���ӳɷ�Ӧ C20H42![]() C10H22+C10H20 �����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ���������
C10H22+C10H20 �����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ���������
����������1����װ���������ӵ�˳��Ӧ��ѭ�������ϡ������ҵ�ԭ����װ��ҩƷ֮ǰҪ����װ�õ�������������ʯ�ͷ���ҵ�ķ�����ԭ���������˳������������ó�������������������������������ݴ��ѻ�ԭ�������з�Ӧ���п��ܷ�����
a.C20H42![]() C10H20+C10H22��b.C10H22
C10H20+C10H22��b.C10H22![]() C5H12+C5H10��c.C5H12
C5H12+C5H10��c.C5H12![]() C2H4+C3H8��d.C5H12
C2H4+C3H8��d.C5H12![]() CH4+C4H8����2���Թܢ�����Һ������,˵��������5��̼ԭ�������ϵ�������Ϊ���³�ѹ��5��̼ԭ�������ϵ�����Һ̬����3���Թܢ���KMnO4��Һ��ɫ˵�������˳��³�ѹ�³���̬��5��̼ԭ�������µ�ϩ������4�������ѻ���������ϩ������,�����巢���ӳɷ�Ӧ�����Բ���������ȡ±�ص�������5����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽΪC20H42
CH4+C4H8����2���Թܢ�����Һ������,˵��������5��̼ԭ�������ϵ�������Ϊ���³�ѹ��5��̼ԭ�������ϵ�����Һ̬����3���Թܢ���KMnO4��Һ��ɫ˵�������˳��³�ѹ�³���̬��5��̼ԭ�������µ�ϩ������4�������ѻ���������ϩ������,�����巢���ӳɷ�Ӧ�����Բ���������ȡ±�ص�������5����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽΪC20H42![]() C10H20+C10H22����6�������ϱ仯���Կ�����ʯ���ѻ�����ҪĿ���ǿ����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ�����������
C10H20+C10H22����6�������ϱ仯���Կ�����ʯ���ѻ�����ҪĿ���ǿ����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ�����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ǣ� ��
A.���ά����Ҫ�ɷ��ǹ�����B.�������Ż�ʱ��������ˮ���
C.��������������ɫ�����Ϳ��D.�����¿�����������ʢװŨ�����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��һ�������´ﵽ��ѧƽ��ʱ������˵������ȷ���ǣ� ��
A.����Ӧ���ʵ����淴Ӧ����
B.�����Ũ�Ȳ��ٷ����仯
C.��Ӧ��ϵ��ij��ֵ���ɱ��ֲ���
D.�����淴Ӧ���ʶ�Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л���A��������ȷ���ǣ� �� 
A.A�����к���2������̼ԭ��
B.A���Ӻ˴Ź���������6�ַ�
C.0.1mol �л���A���������Ľ����Ʒ�Ӧ�ų�0.1mol����
D.A�ܷ����ķ�Ӧ�����У��ӳɡ�ȡ������������������ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ��ͨ�����Ӽ�����������һ�ܵ�ʵ�飬�����6���dz�������![]() ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
ԭ�ӣ����ţ���ѧ����ʹ�����ƵIJ��������۲����6��ԭ������4��������˥�䣬��һʵ��֤ʵ������Ԥ�Ե�˫����˥�䷽ʽ������һ��ԭ��ͬʱ�ų��������ӵ�˥�䷽ʽ���ش��������⣺
(1) ![]() ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
ԭ�ӵĺ���������Ϊ________����ԭ�ӵĺ��������Ϊ________��
(2)���¹���![]() ��������ȷ����________(����ĸ���)��
��������ȷ����________(����ĸ���)��
A�� ![]() ��
��![]() �����ֺ���
�����ֺ���
B����ѧ�һ����һ����Ԫ��
C�� ![]() ��˥�䲻�ǻ�ѧ�仯
��˥�䲻�ǻ�ѧ�仯
D��������ԭ��˥��ų��������Ӻ���![]()
(3)ijͬѧ��Ϊ![]() ��һ��������Ҳ����������Ӧ�������ж�������___________________________��
��һ��������Ҳ����������Ӧ�������ж�������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ� �� 
A.WԪ�صĵ�һ������С��YԪ�صĵ�һ������
B.Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ
C.p�ܼ�δ�ɶԵ���������ZԪ��
D.XԪ���ǵ縺������Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��24.8kJmol��1
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=��47.2kJmol��1
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=+640.5kJmol��1
��14g CO����������FeO��ַ�Ӧ�õ�Fe���ʺ�CO2����ʱ���ͷŻ����յ�����Ϊ�� ��
A.�ų�218 KJ
B.�ų�109kJ
C.����218 kJ
D.����109 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������·�Ӧ�Ƶã�C4H10O ![]() C4H8
C4H8 ![]() C4H8Br2�����������Ľṹ��ʽ�������ǣ� ��
C4H8Br2�����������Ľṹ��ʽ�������ǣ� ��
A.CH3CH2CHBrCH2Br
B.CH3CH��CH2Br��2
C.CH3CHBrCHBrCH3
D.��CH3��2CBrCH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̲��ں��Ĵ�������ȼ�������俪�������ǵ�ǰ�����ԴΣ������Ҫ���⡣�ü�����ˮú��(CO��H2)���ٺϳɼ״����Դ������湩Ӧ���ŵ�ȼ�͡������Dz���ˮú���ļ��ַ�����
�� CH4(g)��H2O (g)��CO (g)��3H2(g) ��H1��+206.2kJ��mol-1
�� CH4(g)�� ![]() O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
�� CH4 (g)��2H2O (g)��CO2 (g)��4H2(g) ��H3��+165.0 kJ��mol-1
��1��CH4(g)��CO2 (g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ��
��2��Ҳ�ɽ�CH4��Ƴ�ȼ�ϵ�أ��������Դ���⣬����ͼװ����ʾ������ͨ����飬�ڱ�״���£����ļ���VL��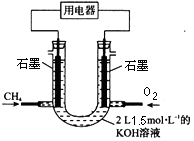
��0��V��33.6Lʱ�������缫��ӦΪ��
��V=44.8Lʱ����Һ������Ũ�ȴ�С��ϵΪ��
��3����ҵ�ϳɰ�ʱ���ϳ�����ÿ����1molNH3 �� �ų�46.1kJ��������
ijС���о��������¶��¸÷�Ӧ�����е������仯�����Ƿֱ��������ΪVL���������º����ܱ������м���һ�����ķ�Ӧ�ʹ������ͬ�¶��·�����Ӧ������������£�
���� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ�� | ��ƽ��ʱ��ϵ | ||
N2 | H2 | NH3 | |||
�� | 1 | 4 | 0 | t1 min | �ų�������36.88kJ |
�� | 2 | 8 | 0 | t2 min | �ų�������Q |
���������У�0-t1ʱ���ƽ����Ӧ����Ϊ��(H2)=��
������������ȷ���� (����ĸ���)��
a��ƽ��ʱ����������H2������������
b���������з�Ӧ��ƽ��״̬ʱ��Q��73.76kJ
c����Ӧ��ʼʱ���������з�Ӧ�Ļ�ѧ��Ӧ�������
d��ƽ��ʱ��������N2��ת���ʣ���<��
e���������ﵽƽ��ʱ����ʱ��t1>t2
��4����ͼ���ڷ�Ӧ���н�N2��H2�����ʵ���֮��Ϊ1:3�������200�桢400�桢600���£���Ӧ�ﵽƽ��ʱ���������NH3�����������ѹǿ�ı仯���ߡ�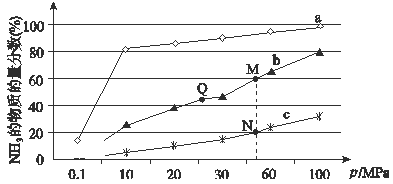
������a��Ӧ���¶�����
����ͼ��M��N��Q��ƽ�ⳣ��K�Ĵ�С��ϵ�� ��
��M���Ӧ��H2ת��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com