
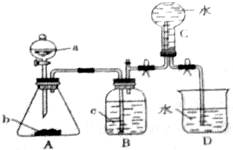
分析 由图可知,分液漏斗中为稀硝酸,锥形瓶中为Cu,二者反应生成硝酸铜、NO和水,装置B除去挥发的硝酸,装置C排水法收集NO,D为尾气处理装置,以此来解答.
解答 解:(1)由图可知,仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)A中发生Cu与稀硝酸的反应,反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成硝酸铜体现硝酸的酸性,生成NO体现硝酸的强氧化性;有4mol HNO3被还原时该反应中转移电子总数为4mol×(5-2)×NA=12NA,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;酸性和强氧化性;12NA;
(3)因硝酸易挥发,生成NO中混有硝酸,则装置B的作用是除去硝酸,故答案为:除去硝酸;
(4)A中发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、2NO+O2=2NO2,观察到金属溶解,得到蓝色溶液,生成无色气体,在锥形瓶上方变为红棕色,
故答案为:金属溶解,得到蓝色溶液,生成无色气体,在锥形瓶上方变为红棕色.
点评 本题考查NO的制备实验,为高频考点,把握Cu与硝酸的反应及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应不必加热就一定能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
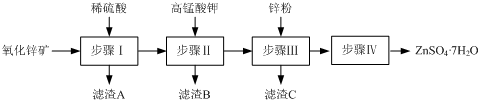
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
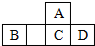 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
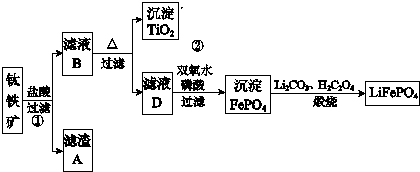
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
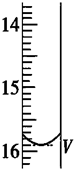 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com