
| A. | 丁烷有3种同分异构体 | |
| B. | 己烷共有5种同分异构体,它们的熔、沸点各不相同 | |
| C. | “可燃冰”的主要成分是甲烷和水 | |
| D. | 多氯代甲烷常为有机溶剂,其中分子结构为正四面体的是四氯化碳 |
分析 A.丁烷有2种同分异构体;
B.己烷有五种同分异构体;
C.可燃冰的主要成分为CH4•8H2O;
D.四氯化碳为正四面体.
解答 解:A.丁烷分子式为C4H10,有2种同分异构体,正丁烷结构简式为CH3CH2CH2CH3,异丁烷结构简式为(CH3)2CHCH3,故A错误;
B.己烷有五种同分异构体,其碳链结构分别为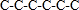 、
、 、
、 、
、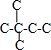 、
、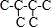 ,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B正确;
,己烷同分异构体为不同物质,所以其熔沸点不同,且含有支链越多其熔沸点越低,故B正确;
C.可燃冰的主要成分为CH4•8H2O,含甲烷和水,故C正确;
D.在多氯代甲烷常为有机溶剂,分子结构为正四面体的为四氯化碳,故D正确,
故选A.
点评 本题考查有机物的结构与性质,为高频考点,主要涉及同分异构体,可燃冰的化学式,四氯化碳空间构型,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 镁是一种重要的金属资源,在各领域都具有重要的作用.
镁是一种重要的金属资源,在各领域都具有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱:F2>Cl2>Br2 | B. | 非金属性:O>S>Se | ||
| C. | 还原性强弱:F->Cl->I- | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH有酸性,而醇、酮类物质没有酸性 | |
| B. | 甲苯使酸性高锰酸钾褪色,而苯不能使其褪色 | |
| C. | 苯酚遇铁离子发生显色反应,而醇不能 | |
| D. | 乙醛与HCN发生加成反应,乙烯不能与之加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的3个碳原子不在同一直线上 | |
| B. | 丙烷可与氯水发生取代反应 | |
| C. | 丙烷能使溴水、酸性KMnO4溶液都褪色 | |
| D. | 丙烷可与强酸或强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
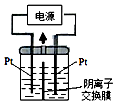 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.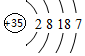 ,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.
,碘是紫黑色(填颜色)固体物质.(2)牙齿的损坏实际上是牙釉质羟基磷灰石[Ca5(PO4)3OH]溶解的结果,糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.使用含氟牙膏会保护牙齿,因为氟离子会跟羟基磷灰石[Ca5(PO4)3OH]发生反应生成氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀氟,用离子方程式表示这一过程Ca5(PO4)3OH(S)+F- (aq)?Ca5(PO4)3 F(S)+OH-(aq).此外氟离子还能抑制口腔细菌产生酸,含氟牙膏已经普遍使用.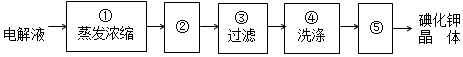
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
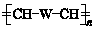 (W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下
(W是链接中的部分结构)是一类重要的功能高分子材料,聚合物X是其中的一种,转化路线如下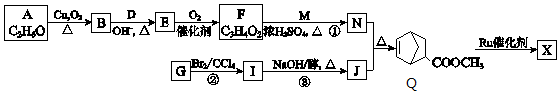
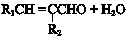
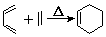
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$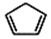 +2 NaBr+2 H2O
+2 NaBr+2 H2O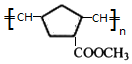
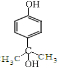 或
或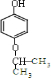 ,(写出其中一种即可)
,(写出其中一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
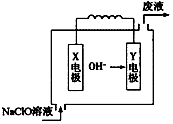
| A. | 该反应的氧化剂是ClO- | |
| B. | 该反应中有两种离子生成 | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应消耗1mol还原剂时,转移的电子为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | H2O和D2O | ||
| C. | O2与O3 | D. | CH3OCH3与CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com