
【题目】回答下列问题:
(1)用“>”或“<”填写下表。
第一电离能 | 熔点 | 沸点(同压) | 键能 |
P____S | MgO____CaS | CF4____SiCl4 | H-Cl____ H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2 + 6H2O+ 6NH3 = 4SO![]() +6NH4++2NH2OH。
+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH3分子的空间构型为____。
③NH2OH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为____(不考虑空间构型)。
【答案】 > > < > H N O 三角锥 NH2OH与H2O之间可以形成氢键 
【解析】(1)由于P原子的3p轨道电子处于半充满状态,稳定性强,所以第一电离能大于S原子的第一电离能,故第一电离能P>S;由于CaS和MgO形成的晶体都是离子晶体,形成离子晶体的离子半径越小,电荷数越多,晶格能越大,熔点就越高。氧离子半径小于硫离子半径,镁离子半径小于钙离子半径,所以熔点MgO>CaS;由于SiCl4 和CF4的结构、性质相似,且二者形成的晶体是分子晶体,物质的沸点和分子间作用力大小有关系。由于相对分子质量越大,分子间作用力越大,所以沸点CF4<SiCl4;由于HCl 和HBr的结构、性质相似,且二者形成的晶体是分子晶体,原子半径越小,键长越短,键能越大,故键能H-Cl>H-Br;(2)①根据电负性的判断依据,H、N、0的电负性的大小顺序为H<N<O;②NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;③NH2OH极易溶于H2O,除因为它们都是极性分子外,还因为NH2OH与H2O之间可以形成氢键;(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为 。
。


科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是
A. 碳酸钠溶液呈碱性:CO32— + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O = 2Fe(OH)3
C. 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
D. 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 2v正(CO)=v逆(H2O)
C. 生成n molCO的同时生成n mol H2
D. 1 mol H-H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是______,属于非电解质_______。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用单线桥标出电子转移的情况____________;
②浓H2SO4表现出来的性质是:_______;当电子转移0.1mol时,消耗氧化剂的物质的量为_______。
(4)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是_______,这样操作所配制的溶液比要求的浓度要_________ (填“偏高”、“偏低”、“不影响”)。配制应称取NaOH________g。
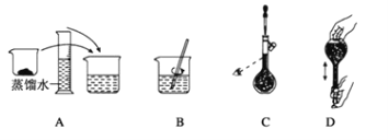
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
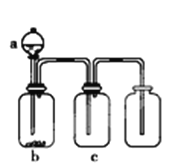
气体 | a | b | c | |
A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
D | O2 | 双氧水 | MnO2 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,实验按以下步骤进行:
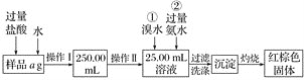
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式:_______________________________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是______________________________。若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
Ⅱ.有同学提出,还可以采用以下方法来测定:
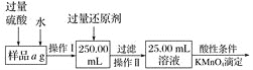
(4)溶解样品改用了硫酸,而不再用盐酸,为什么? ______________________________。
(5)选择的还原剂是否能用铁________(填“是”或“否”),原因是:___________________。
(6)若滴定用掉cmol·L-1KMnO4溶液bmL,则样品中铁元素的质量分数是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com